
����Ŀ��S2Cl2��һ����Ҫ�Ļ�����Ʒ������ʱ��һ���ж����ж���Ľ��ɫҺ�壬�۵㣭76�棬�е�138�棬����ˮ��Ӧ����һ���Ȼ��ɵ�SCl2��SCl2��ӣ�Һ�ɫҺ�壬�ӷ����۵㣭122�棬�е�59�档SCl2 ��S2Cl2���ƣ��ж����ж�����Ҹ����ȶ���S2Cl2��������װ���Ʊ���
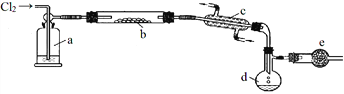
�ش��������⣺
��1��д��S2Cl2�ĵ���ʽ________________��װ��a�е��Լ���________________��
��2��д��ʵ������ȡCl2�����ӷ�Ӧ����ʽ________________________
��3��װ��b�з�����Ӧǰ������еIJ�����________________________��
��4��װ��e������___________________________��
��5��Ϊ�˻�õ�������S2Cl2����Ҫ���еIJ���������________________��
��6����S2Cl2����ˮ�л�������������壬д��S2Cl2��ˮ��Ӧ�Ļ�ѧ����ʽ________________������������������ķ�����_________________________��
���𰸡� ![]() Ũ���� MnO2��4H+��2Cl��
Ũ���� MnO2��4H+��2Cl��![]() Mn2+��Cl2����2H2O�����������𰸾����֣� ��ͨ��Cl2���ž�װ���еĿ�������ͨ��Cl2 ��ֹ�����е�ˮ��������dʹ��Ʒ��ˮ��Ӧ������ʣ���Cl2��һ��1�֣� �������� 2S2Cl2��2H2O
Mn2+��Cl2����2H2O�����������𰸾����֣� ��ͨ��Cl2���ž�װ���еĿ�������ͨ��Cl2 ��ֹ�����е�ˮ��������dʹ��Ʒ��ˮ��Ӧ������ʣ���Cl2��һ��1�֣� �������� 2S2Cl2��2H2O![]() 3S��SO2��4HCl ������ͨ��Ʒ����Һ�У���ɫ���ټ����ָֻ���ɫ��֤����������SO2������������Ҳ���ֵ����������Һ���У�
3S��SO2��4HCl ������ͨ��Ʒ����Һ�У���ɫ���ټ����ָֻ���ɫ��֤����������SO2������������Ҳ���ֵ����������Һ���У�
����������S2Cl2�Ʊ�װ�ü������Ϣ��֪��S2Cl2����ˮ��Ӧ������Ӧ���ø�������������ڼ��ȵ��������Ʊ�S2Cl2���ɴ˿���֪װ��a��Ӧʢ��Ũ�������������S2Cl2����������dװ���ռ�������β���к��ж��������Ⱦ����������eװ����β������װ�ã�ͬʱҲ�ɷ�ֹ�����е�ˮ��������dװ����S2Cl2��Ӧ��
��1��Sԭ��������У������ӣ�Clԭ��������У������ӣ�����S2Cl2�ĵ���ʽΪ![]() ��װ��a�е��Լ���Ũ���ᡣ
��װ��a�е��Լ���Ũ���ᡣ
��2��ʵ����ͨ���ö������̺�Ũ���������ȡCl2�����ӷ�Ӧ����ʽΪMnO2��4H+��2Cl��![]() Mn2+��Cl2����2H2O��
Mn2+��Cl2����2H2O��
��3��װ��b�з�����Ӧǰ������еIJ�������ͨ��Cl2���ž�װ���еĿ�����
��4��װ��e�����Ƿ�ֹ�����е�ˮ��������dʹ��Ʒ��ˮ��Ӧ������ʣ���Cl2����
��5�����ڲ�Ʒ�п��ܻ������Ʒ�е����ϴ��SCl2������ͨ����������õ�������S2Cl2��
��6����S2Cl2����ˮ�л�������������壬���ݸ���Ӧ������Ԫ�ؿ����жϴ˳���Ϊ������ˮ��S��S2Cl2������SΪ+���ۡ�ClΪ-���ۣ�����������ԭ��Ӧ�л��ϼ۵ı仯���ɣ������ж����ɵ�����ΪSO�������� S2Cl2��ˮ��Ӧ�Ļ�ѧ����ʽ2S2Cl2��2H2O![]() 3S��SO2����4HCl������������������ķ����ǰ�����ͨ��Ʒ����Һ�У���ɫ���ټ����ָֻ���ɫ��֤����������SO2��
3S��SO2����4HCl������������������ķ����ǰ�����ͨ��Ʒ����Һ�У���ɫ���ټ����ָֻ���ɫ��֤����������SO2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ͷ��ˮ�з�����ѧ��Ӧ��ˮ������������
A. �� B. ������ C. ̼���� D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��12C��13Cԭ��֮�䣬��ȵ���
A. ԭ������ B. ������ C. ������ D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ����ѧ���̵�ʾ��ͼ��

��1��ͼ�м׳���OH-���� ��(�CH3OH����O2��)��
��2��д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ�� ��
��3�����ҳ����缫�����μ�������ɫʯ����Һ���������ĵ缫Ϊ ��(�A����"B��)����д���˵缫�ķ�Ӧʽ��____ ��
��4���ҳ����ܷ�Ӧ�����ӷ���ʽ��____ ��
��5�����ҳ���B(Ag)������������5.4gʱ���ҳص�pH�� (����ʱ�ҳ�����Һ�����Ϊ500mL)����ʱ����ij�缫����1.60gij����������е�ij����Һ������ (�����)��
A�� MgSO4 B��CuSO4 C��AgNO3 D��AlCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������û�ת��NO2��SO2��CO��NO����Ⱦ�����������ǹ�ͬ��ע�Ŀ��⡣
����ij��ѧ����С��������Ϻ��֪:2NO(g)��O2(g)![]() 2NO2(g)�ķ�Ӧ���̷�������
2NO2(g)�ķ�Ӧ���̷�������
��2NO(g)![]() N2O2(g)(��) v1��=k1����c2(NO)��v1��=k1����c(N2O2)��H1<0
N2O2(g)(��) v1��=k1����c2(NO)��v1��=k1����c(N2O2)��H1<0
��N2O2(g)��O2(g)![]() 2NO2(g)(��)�� v2��=k2����c(N2O2)��c(O2)��v2��=k2����c2(NO2) H2<0
2NO2(g)(��)�� v2��=k2����c(N2O2)��c(O2)��v2��=k2����c2(NO2) H2<0
��ش�����������

��1����Ӧ2NO(g)��O2(g)![]() 2NO2(g)��H��________________(�ú�H1��H2��ʽ�ӱ�ʾ)��һ���¶�������Ӧ2NO(g)��O2(g)
2NO2(g)��H��________________(�ú�H1��H2��ʽ�ӱ�ʾ)��һ���¶�������Ӧ2NO(g)��O2(g)![]() 2NO2(g)�ﵽƽ��״̬��д����k1����k1����k2����k2����ʾƽ�ⳣ���ı���ʽK��_____________________��
2NO2(g)�ﵽƽ��״̬��д����k1����k1����k2����k2����ʾƽ�ⳣ���ı���ʽK��_____________________��
��2������2NO(g)��O2(g)![]() 2NO2(g)��Ӧ�����Ƿ�Ӧ������Ӧ�ٵĻ��E1�뷴Ӧ�ڵĻ��E2�Ĵ�С��ϵΪE1________E2(����>������<������=��)��
2NO2(g)��Ӧ�����Ƿ�Ӧ������Ӧ�ٵĻ��E1�뷴Ӧ�ڵĻ��E2�Ĵ�С��ϵΪE1________E2(����>������<������=��)��
������3����ӦN2O4(g)![]() 2NO2(g)����һ��������N2O4��NO2����������������ѹǿ�����¹�ϵ��v(N2O4)��k1��p(N2O4)��v(NO2)��k2��p2(NO2)������k1��k2�����¶��йصij�����һ���¶��£���Ӧ��������ѹǿ��ϵ��ͼ��ʾ����ͼ�б���ĵ��У��ܱ�ʾ�÷�Ӧ�ﵽƽ��״̬����������_______________��������__________________________________________________________________________________________��
2NO2(g)����һ��������N2O4��NO2����������������ѹǿ�����¹�ϵ��v(N2O4)��k1��p(N2O4)��v(NO2)��k2��p2(NO2)������k1��k2�����¶��йصij�����һ���¶��£���Ӧ��������ѹǿ��ϵ��ͼ��ʾ����ͼ�б���ĵ��У��ܱ�ʾ�÷�Ӧ�ﵽƽ��״̬����������_______________��������__________________________________________________________________________________________��
��4����25��ʱ����a mol��L��1�İ�ˮ��Һ��0.02 mol��L��1 HCl��Һ�������Ϻ���Һǡ�ó����ԣ�������Һ��Ϻ�����ı仯�����ú�a�ı���ʽ��ʾ250CʱNH3��H2O�ĵ��볣��Kb��_________________������������Ϊ17%���ܶ�Ϊ0.93 g/cm3�İ�ˮ������200 mL a mol��L��1�İ�ˮ��Һ������ԭ��ˮ�����V��___________mL��
��5����ͼ���װ�ÿɽ������е�NO��SO2�ֱ�ת��ΪNH4+��SO42��������A�Ļ�ѧʽΪ_________�������ĵ缫��Ӧʽ��__________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӹ���ķ�����Һ�к���2%��5%��NaNO2������һ�ֻ�����Ⱦ�������NH4Cl��Һ�������˷�����Һ��ʹ��������ת��Ϊ�����ʡ��÷�Ӧ���������У�
��һ����NaNO2+NH4Cl![]() NaCl+NH4NO2
NaCl+NH4NO2
�ڶ�����NH4NO2![]() N2��+2H2O
N2��+2H2O
���жԵڶ�����Ӧ����������ȷ����
��NH4NO2����������
��NH4NO2���ǻ�ԭ��
��NH4NO2�����˷ֽⷴӦ
��ֻ�е�Ԫ�صĻ��ϼ۷����˱仯
��NH4NO2�������������ǻ�ԭ��
A���٢� B���٢�
C���ڢۢ� D���ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Լ����Ԫ�ص����ʣ����ϵ��µݱ������ȷ����
A. ����������
B. ���ϼ�������
C. ʧ������������ǿ
D. ����������Ӧ��ˮ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����:
A. �����л�����ϩ�������Ը��������Һ����ȥ
B. �ں����������п�鱣����Dz��ܸ�ʴ�Dz�������������������������
C. ��֪2SO2��g��+ O2��g��![]() 2SO3 ��g�� ��H��0���÷�Ӧ���κ��¶��¾����Է�����
2SO3 ��g�� ��H��0���÷�Ӧ���κ��¶��¾����Է�����
D. �����£�Ksp��AgCl��=1.8��10-10��Ksp��Ag2CrO4��=9.0��10-12����Ũ����ȵ�Na2CrO4��KCl��Һ�еμ�AgNO3��Һ����������Ag2CrO4����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaCl��Na2SO4��NaNO3�Ļ������ѡ���ʵ����Լ���ȥ�������Ӷ��õ�������NaNO3��������Ӧ��ʵ��������ͼ��ʾ��

��ش�����������
(1)д��ʵ���������������ʵĻ�ѧʽ���Լ�X ������A ��
(2)����ʵ���������٢ڢ�����Ҫ���е�ʵ������� (���������)��
(3)����ʵ�������м������Na2CO3��Һ��Ŀ���� ��
(4)����ʵ�鷽���õ�����Һ3�п϶����� (�ѧʽ)���ʡ�Ϊ�˽�������������������Һ3�м��������� (�ѧʽ)��֮����Ҫ���NaNO3����������е�ʵ������� (���������)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com