
【题目】如图当线路接通时,发现M(用石蕊试液浸润过的滤纸)a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂。回答:
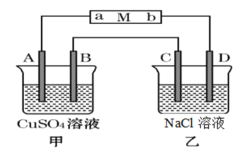
(1)甲、乙分别是什么装置_____________、______________。
(2)A电极材料为_____________,B电极上的电极反应为:______________。
(3)请解释a处变蓝的原因:________________
(4)已知乙中溶液体积为100 mL,当B上析出0.32 g红色物质时,此时乙中溶液的pH=__________(不考虑溶液体积的变化,温度为室温)。
【答案】原电池 电解池或电解槽 Zn Cu2++2e-=Cu a端为电解池的阴极,水电离出的H+放电,使水电离平衡右移,溶液中c(OH-)>c(H+),溶液呈碱性,使石蕊试液变蓝 13
【解析】
线路接通时,发现M(用石蕊试液浸润过的滤纸)a端显蓝色,则a端为碱性,氢离子放电,a极为阴极;b端显红色,则b端为酸性,氢氧根离子放电,b极是阳极。根据电解原理可知:和电源的正极相连的是阳极,和电源的负极相连的是阴极,根据原电池、电解池的构成条件以及工作原理知识来回答。
线路接通时,发现M(用石蕊试液浸润过的滤纸)a端显蓝色,则a端为碱性,氢离子放电,a极为阴极;b端显红色,则b端为酸性,氢氧根离子放电,b极是阳极。
(1)甲中电极材料是锌、银,有活动性不同的电极,与电解质溶液形成了闭合回路,Zn能够与CuSO4溶液自发进行氧化还原反应,因此甲池为原电池,Zn作负极,Ag作正极;乙池中两个电极都是铂电极,与原电池相连形成闭合回路,则乙池为电解池;
(2)根据上述分析可知a为阴极,与电源负极连接;b为阳极,与电源的正极连接。由于甲池为原电池,金属活动性Zn>Ag,所以Zn为负极,Ag为正极,所以甲池中与a连接的电极A为Zn电极,与b连接的电极B为Ag电极,正极Ag上溶液中的Cu2+得到电子,发生还原反应,电极反应式为:Cu2++2e-=Cu;
(3)a处与电源负极连接,为电解池的阴极,石蕊试液中的水电离产生的H+不断放电,破坏了负极的水的电离平衡,使水的电离平衡正向移动,最终达到平衡时,附近溶液中c(OH-)>c(H+),溶液显碱性,因此使石蕊试液变蓝色;
(4)B电极发生反应:Cu2++2e-=Cu,当B上析出0.32 g红色物质时,产生Cu的物质的量是n(Cu)=![]() =0.005 mol,则转移电子的物质的量为n(e-)=2n(Cu)=0.01 mol,乙池总反应方程式为:2NaCl+2H2O
=0.005 mol,则转移电子的物质的量为n(e-)=2n(Cu)=0.01 mol,乙池总反应方程式为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,根据方程式可知:每产生2 mol NaOH时,转移2 mol电子。由于在同一闭合回路中电子转移数目相等,所以转移0.01 mol电子时,反应产生NaOH的物质的量是0.01 mol,乙池溶液体积是100 mL,则反应产生NaOH溶液的浓度为c(NaOH)=
Cl2↑+H2↑+2NaOH,根据方程式可知:每产生2 mol NaOH时,转移2 mol电子。由于在同一闭合回路中电子转移数目相等,所以转移0.01 mol电子时,反应产生NaOH的物质的量是0.01 mol,乙池溶液体积是100 mL,则反应产生NaOH溶液的浓度为c(NaOH)=![]() =0.1 mol/L,则溶液中c(H+)=
=0.1 mol/L,则溶液中c(H+)=![]() mol/L=10-13 mol/L,所以该溶液的pH=13。
mol/L=10-13 mol/L,所以该溶液的pH=13。


科目:高中化学 来源: 题型:
【题目】常温条件下,下列各组离子在相应的条件下可能大量共存的是( )
A.能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B.由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C.在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe3+、Cl-、NO3-
D.![]() =10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸(CH3COOH)是一种常见的弱酸。
(1)为用实验证明醋酸是弱电解质,实验小组同学设计如下几种方案:
①用pH试纸测出0.1mol/L的醋酸溶液pH:若pH___1(填“>”、“<”或“=”),则证明醋酸是弱酸;
②先测0.1mol/L醋酸的pH ;量取该溶液5mL用蒸馏水稀释至500mL,再测其pH,若________________,则证明醋酸是弱电解质;
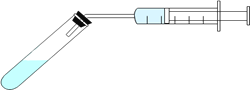
③分别配制pH相同的醋酸和盐酸,各取10mL与足量的锌粒反应(装置如图),测试在不同时间间隔中得到H2的量,即可证明醋酸是弱电解质。下列示意图(X为醋酸,Y为盐酸)中,符合该实验结果的是__________(选填字母);
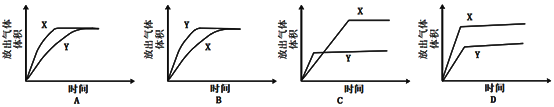
但在该实验中难以实现之处为__________________________________。(举例)
(2)醋酸和氢氧化钠反应生成醋酸钠(CH3COONa)。
①将CH3COONa固体溶于蒸馏水后其溶液显碱性,其原因是(用离子方程式表示)______________________________;在该溶液中,下列关系式中正确的是________;(选填字母)
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(OH-)=c(H+)+c(CH3COOH)
C.c(CH3COO-)+c(OH-)=c(H+)+c(Na+)
D.c(CH3COO-)>c(OH-)>c(Na+)>c(H+)
②醋酸和氢氧化钠反应后得到溶液中溶质的组成有多种可能:
若得到的溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),试推断该溶液中的溶质为_____;
若得到的溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则可以推断该溶液中的溶质可能为____;
③将amol/LCH3COOH稀溶液和bmol/LNaOH稀溶液等体积混合:
若测得溶液中c(OH-)=c(H+),则a___b;(选填“>”、“<”、“=”、“≤”或“≥”)
若测得溶液中c(OH-)>c(H+),则a___b;(选填“>”、“<”、“=”、“≤”或“≥”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgI为黄色沉淀,AgCl为白色沉淀。25°C时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5mL含有KCl和KI浓度均为0.01mol·L-1的混合溶液中,滴加8mL0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是
A. 溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3—)>c(Cl-)>c(I-)>c(Ag+)
B. 溶液中先产生的是AgI沉淀
C. AgCl的Ksp的数值为1.69×10-10
D. 若在AgI悬浊液中滴加少量的KCl稀溶液,黄色沉淀不会转变成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):
(1)装置A中反应的化学方程式是________.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是 ______。
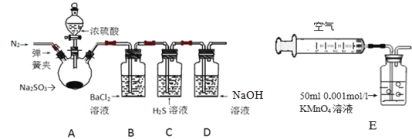
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中,向第1支试管中滴加适量氨水出现白色沉淀___________(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是______。
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有___ 性.
(5)装置D的作用是______。
(6)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样.并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验.请计算该空气中SO2的体积分数(用含V的代数式表示)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。

(1)混合气体A的主要成分是____________。
(2)气体B为__________,蓝色溶液D为____________。
(3)单质M与浓硝酸反应的化学方程式是____________________________。
(4)单质C与稀硝酸反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在100 ℃、1.01×105 Pa下,1 mol氢气在氧气中燃烧生成气态水的能量变化如图所示,下列有关说法不正确的是( )
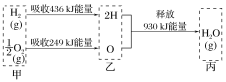
A.1 mol H2O(g)分解为2 mol H与1 mol O时吸收930 kJ热量
B.热化学方程式为:2H2(g)+O2(g)=2H2O(g) ΔH=-490 kJ·mol-1
C.甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
D.乙→丙的过程中若生成液态水,释放的能量将小于930 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为没食子酸(记做W),在一定条件下W可分别转化为X、Y,下列说法正确的是( )
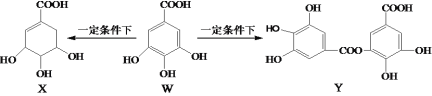
A.X和W都能与溴水发生加成反应
B.X能发生加成、消去、缩聚等反应
C.1molY最多能与7molNaOH发生反应
D.1molY水解生成两种有机化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质属于同分异构体是___;属于同素异形体是___;属于同位素是___;属于同一种物质是___。(写序号)
①红磷与白磷 ②12C与14C ③干冰与二氧化碳 ④CH4与CH3CH3 ⑤S2与S8 ⑥235U与238U ⑦![]() 与
与![]() ⑧乙醇(
⑧乙醇( )与二甲醚(
)与二甲醚(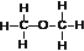 ) ⑨
) ⑨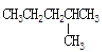 和
和![]() ⑩氰酸铵(NH4CNO)与尿素[CO(NH2)2]
⑩氰酸铵(NH4CNO)与尿素[CO(NH2)2]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com