
【题目】醋酸(CH3COOH)是一种常见的弱酸。
(1)为用实验证明醋酸是弱电解质,实验小组同学设计如下几种方案:
①用pH试纸测出0.1mol/L的醋酸溶液pH:若pH___1(填“>”、“<”或“=”),则证明醋酸是弱酸;
②先测0.1mol/L醋酸的pH ;量取该溶液5mL用蒸馏水稀释至500mL,再测其pH,若________________,则证明醋酸是弱电解质;
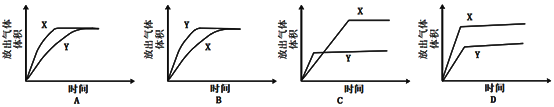
③分别配制pH相同的醋酸和盐酸,各取10mL与足量的锌粒反应(装置如图),测试在不同时间间隔中得到H2的量,即可证明醋酸是弱电解质。下列示意图(X为醋酸,Y为盐酸)中,符合该实验结果的是__________(选填字母);
但在该实验中难以实现之处为__________________________________。(举例)
(2)醋酸和氢氧化钠反应生成醋酸钠(CH3COONa)。
①将CH3COONa固体溶于蒸馏水后其溶液显碱性,其原因是(用离子方程式表示)______________________________;在该溶液中,下列关系式中正确的是________;(选填字母)
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(OH-)=c(H+)+c(CH3COOH)
C.c(CH3COO-)+c(OH-)=c(H+)+c(Na+)
D.c(CH3COO-)>c(OH-)>c(Na+)>c(H+)
②醋酸和氢氧化钠反应后得到溶液中溶质的组成有多种可能:
若得到的溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),试推断该溶液中的溶质为_____;
若得到的溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则可以推断该溶液中的溶质可能为____;
③将amol/LCH3COOH稀溶液和bmol/LNaOH稀溶液等体积混合:
若测得溶液中c(OH-)=c(H+),则a___b;(选填“>”、“<”、“=”、“≤”或“≥”)
若测得溶液中c(OH-)>c(H+),则a___b;(选填“>”、“<”、“=”、“≤”或“≥”)
【答案】> △pH<2 D 锌粒和酸的接触面积相同/配相同pH的溶液 CH3COO-+H2OCH3COOH+OH- ABC NaOH、CH3COONa CH3COOH、CH3COONa > >、< 或 =
【解析】
(1)①若醋酸是弱酸,在水溶液中不能完全电离,0.1mol/L的醋酸溶液中氢离子浓度小于0.1mol/L;
②醋酸是弱酸,稀释前后的pH差小于2;
③刚开始醋酸和盐酸的pH相等,氢离子浓度相等,因为醋酸在反应过程中还在不断出氢离子,则醋酸与锌粒反应的速率更快;之后又因为醋酸是弱酸,其浓度要大于盐酸的浓度,最终会生成更多的氢气;
(2) ①CH3COONa固体溶于蒸馏水后会发生水解,导致其溶液显碱性;CH3COONa溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),物料守恒:c(Na+)=c(CH3COO-)+c(CH3COOH),结合电荷守恒和物料守恒可以得到:c(OH-)=c(H+)+c(CH3COOH);
②若c(OH-)>c(CH3COO-)> c(H+)时说明溶液中氢氧化钠过量;若c(H+)>c(OH-)时说明溶液中醋酸过量;
③若c(OH-)=c(H+),溶液显中性,一定为醋酸和醋酸钠的混合液;若c(OH-)>c(H+),溶液显碱性,可能为醋酸钠溶液或醋酸钠和NaOH的混合液。
(1)①若醋酸是弱酸,在水溶液中不能完全电离,0.1mol/L的醋酸溶液中氢离子浓度小于0.1mol/L,pH>1;
②取该溶液5ml用蒸馏水稀释至500毫升,相当于稀释100倍,如果醋酸是强酸,前后的pH差△pH=2,若两者的pH差△pH<2,则可证明醋酸是弱电解质;
③刚开始醋酸和盐酸的pH相等,氢离子浓度相等,因为醋酸在反应过程中还在不断出氢离子,则醋酸与锌粒反应的速率更快;之后又因为醋酸是弱酸,其浓度要大于盐酸的浓度,最终会生成更多的氢气,故选D;反应过程中难以实现之处为:锌粒和酸的接触面积相同和配相同pH的溶液;
(2) ①CH3COONa固体溶于蒸馏水后会发生水解,导致其溶液显碱性,离子方程式为:CH3COO-+H2OCH3COOH+OH-;CH3COONa溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),物料守恒:c(Na+)=c(CH3COO-)+c(CH3COOH),结合电荷守恒和物料守恒可以得到:c(OH-)=c(H+)+c(CH3COOH);浓度大小:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);故选ABC;
②若c(OH-)>c(CH3COO-)> c(H+)时说明溶液中氢氧化钠过量,是氢氧化钠和醋酸钠的混合溶液,推断该溶液中的溶质为:NaOH、CH3COONa;
若c(H+)>c(OH-)时说明溶液中醋酸过量,是醋酸和醋酸钠的混合溶液, 可以推断该溶液中的溶质为:CH3COOH、CH3COONa;
③若c(OH-)=c(H+),溶液显中性,一定为醋酸和醋酸钠的混合液,则a>b;
若c(OH-)>c(H+),溶液为醋酸钠溶液或醋酸钠和NaOH的混合液或大量醋酸钠和少量醋酸的混合液,则a可能大于b,也可能等于b,还可能小于b。


科目:高中化学 来源: 题型:
【题目】对于反应2A+B![]() 3C+4D,表示反应速率最快的是
3C+4D,表示反应速率最快的是
A.VA=0.75mol/(L·s)B.VB=0.5mol/(L·s)C.VC=1.0mol/(L·s)D.VD=1.5mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下.下列说法正确的是( )
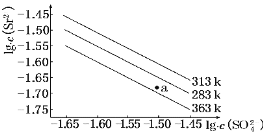
A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最小
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有100mL1.5mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入2.7g的铝粉,计算反应结束后生成的气体的体积比是( )
A.1:1B.1:2C.2:1D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图当线路接通时,发现M(用石蕊试液浸润过的滤纸)a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂。回答:
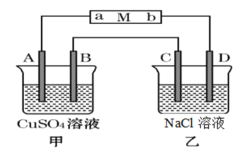
(1)甲、乙分别是什么装置_____________、______________。
(2)A电极材料为_____________,B电极上的电极反应为:______________。
(3)请解释a处变蓝的原因:________________
(4)已知乙中溶液体积为100 mL,当B上析出0.32 g红色物质时,此时乙中溶液的pH=__________(不考虑溶液体积的变化,温度为室温)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种金属组成的合金A,在合适的条件下可按下图进行反应(部分产物和水省略),已知F为红褐色沉淀,请回答:
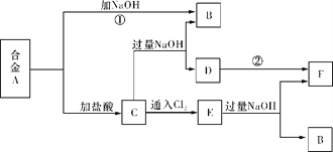
(1)溶液C的溶质主要是____________________(填化学式)。
(2)写出反应②的化学方程式_______________________________________________。描述D变F的实验现象_______________________________________________。
(3)写出反应C→E的离子方程式________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com