
【题目】![]() 环境科学
环境科学![]() 刊发了我国科研部门采用零价铁活化过硫酸钠
刊发了我国科研部门采用零价铁活化过硫酸钠![]() ,其中S为
,其中S为![]() 价
价![]() 去除废水中的正五价砷
去除废水中的正五价砷![]() 的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为
的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为![]() ,
,![]() 。下列叙述正确的是
。下列叙述正确的是![]()
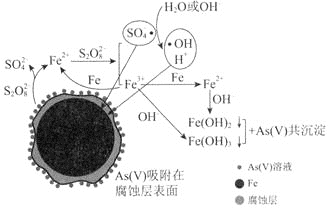
A.![]() 过硫酸钠
过硫酸钠![]() 含
含![]() 个过氧键
个过氧键
B.若![]() 参加反应,共有
参加反应,共有![]() 个
个![]() 被还原
被还原
C.室温下,中间产物![]() 溶于水所得饱和溶液中
溶于水所得饱和溶液中![]() 为
为![]()
D.pH越小,越有利于去除废水中的正五价砷
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】研究SO2的转化对环境保护具有重要意义。
(1)一种将SO2转化为H2SO4和S的反应为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH
已知SO3(g)+H2O(g)=H2SO4(l) ΔH1=-177 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH2=-297 kJ·mol-1
2SO2(g)+O2(g)=2SO3(g) ΔH3=-197 kJ·mol-1 则ΔH=__________kJ·mol-1。
(2)SO2碱吸收液含NaHSO3和Na2SO3,NaHSO3可用于制取焦亚硫酸钠(Na2S2O5)。一种用SO2碱吸收液和三室膜电解技术制取NaHSO3的装置如图甲所示。已知常温下含硫微粒的物质的量分数如图乙所示,H2SO3的电离平衡常数K1=1.23×10-2、K2=5.6×10-8。
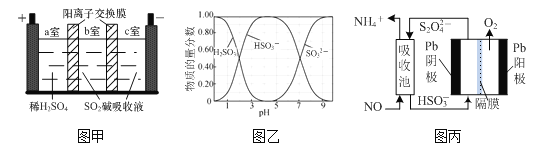
①电解后__________(填“a”、“b”或“c”)室的NaHSO3浓度较大。
②常温下,当SO2碱吸收液的pH=8时,溶液中c(SO32-)∶c(HSO3-)=__________。
③常温下0.1 mol·L-1 NaHSO3溶液中H2SO3、HSO3-、SO32-的物质的量浓度由大到小的顺序是__________。
(3)利用间接电化学法消除NO的原理如图丙所示。
①阴极的电极反应式为__________;
②吸收池每吸收转化1mol NO,阳极区生成标准状况下O2的体积为__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常量的值,最早由奥地利化学及物理学家Johann JosefLoschmidt测得,有时候用上代替NA表示阿伏伽德罗常量的值,下来说法错误的是
A.1.1 g的11B中,含有0.5 NA个质子
B.pH=1的H3PO4溶液中,含有0.1 NA个H+
C.标准状态下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA
D.1 L 1 mol/L NaCl溶液和1 L 1 mol/L NaF溶液中离子总数:前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3H2(g) + N2(g)![]() 2NH3(g) △H〈0在一定条件下达到平衡状态,时间为t1时改变条件,化学反应速率与反应时间关系如图,下列说法中正确的是( )
2NH3(g) △H〈0在一定条件下达到平衡状态,时间为t1时改变条件,化学反应速率与反应时间关系如图,下列说法中正确的是( )
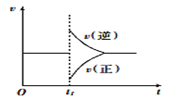
A.维持温度,反应体系体积不变,t1时充入NH3(g)
B.维持温度、压强不变,t1时充入NH3
C.维持温度不变,t1时扩大反应体系体积
D.维持压强不变,t1时升高反应体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述及解释正确的是
A.2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B.H2(g)+I2(g)![]() 2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C.对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡左移
2NH3,平衡后,压强不变,充入O2,平衡左移
D.FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.![]() 时
时![]() ,则该温度下
,则该温度下![]() 饱和溶液中含有
饱和溶液中含有![]() 个
个![]()
B.铅蓄电池放电时负极净增质量比正极净增质量多![]() 时,转移电子数为
时,转移电子数为![]()
C.![]() 溶于水,溶液中
溶于水,溶液中![]() 、
、![]() 、
、![]() 的总数为
的总数为![]()
D.![]() 叠氮化铵
叠氮化铵![]() 发生爆炸
发生爆炸![]()
![]()
![]() 。当转移
。当转移![]() 个电子时,产生
个电子时,产生![]() 标准状况
标准状况![]() 混合气体
混合气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿![]() 主要成分
主要成分![]() 是工业制硫酸的主要原料,暴露在空气中会被缓慢氧化,其氧化过程如图所示。下列有关说法不正确的是
是工业制硫酸的主要原料,暴露在空气中会被缓慢氧化,其氧化过程如图所示。下列有关说法不正确的是

A.发生反应a时,![]() 被氧化时消耗标准状况下空气的体积大约
被氧化时消耗标准状况下空气的体积大约![]()
B.为了验证b溶液中含![]() ,可选用KSCN溶液和氯水
,可选用KSCN溶液和氯水
C.取10 mL b溶液测定其成分,通入标准状况下![]() 22.4 mL恰好完全反应。然后调节pH,使溶液中的铁元素全部转化为沉淀,经过滤、洗涤、灼烧,冷却后称重,得固体质量为0.32g,则b溶液中
22.4 mL恰好完全反应。然后调节pH,使溶液中的铁元素全部转化为沉淀,经过滤、洗涤、灼烧,冷却后称重,得固体质量为0.32g,则b溶液中![]()
D.现有一含有![]() 和
和![]() 的混合样品,采用一定方法测得
的混合样品,采用一定方法测得![]() ,则该样品中
,则该样品中![]() 的物质的量分数为
的物质的量分数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。

(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是______________。
(2)Ⅱ中,2NO(g)+O2(g)![]() 2NO2(g)。在其他条件相
2NO2(g)。在其他条件相
同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。

①比较p1、p2的大小关系:p1________p2(填“<”,“>”或“=”)
②随温度升高,该反应平衡常数变化的趋势是________(填“增大”,“减小”或“不变”)。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)![]() N2O4(g) ΔH12NO2(g)
N2O4(g) ΔH12NO2(g)![]() N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。

②N2O4与O2、H2O化合的化学方程式是____________________。

(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。为使电解产物全部转化为NH4NO3,需补充A。A是______,说明理由:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4mol | 2mol | ||
CO | 2mol | 1mol | ||
CH3OH(g) | 0 | 0.7mol |
①下列各项能作为判断该反应达到平衡标志的是____________(填字母);
A.容器内压强保持不变
B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=_________ (kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=__________kPamin-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com