
【题目】阿伏伽德罗常量的值,最早由奥地利化学及物理学家Johann JosefLoschmidt测得,有时候用上代替NA表示阿伏伽德罗常量的值,下来说法错误的是
A.1.1 g的11B中,含有0.5 NA个质子
B.pH=1的H3PO4溶液中,含有0.1 NA个H+
C.标准状态下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA
D.1 L 1 mol/L NaCl溶液和1 L 1 mol/L NaF溶液中离子总数:前者大于后者
【答案】B
【解析】
A. 11B质子数是5,质量数是11,1.1 g的11B的物质的量是0.1 mol,1个11B原子中含有5个质子,则0.1 mol11B中含有的质子数目为0.5 NA个,A正确;
B. 只有溶液的浓度,缺少溶液体积,不能计算溶液中H+离子数目,B错误;
C. 标准状态下的33.6 L氯气的物质的量n(Cl2)=33.6 L÷22.4 L/mol=1.5 mol,27 gAl的物质的量为1 mol,二者反应方程式为:2Al+3Cl2![]() 2AlCl3,有方程式可知Al、Cl2反应的物质的量的比是2:3=1:1.5,2 mol Al反应转移6 mol电子,则1.5 mol 氯气与27 g铝恰好完全反应,转移电子数为3NA,C正确;
2AlCl3,有方程式可知Al、Cl2反应的物质的量的比是2:3=1:1.5,2 mol Al反应转移6 mol电子,则1.5 mol 氯气与27 g铝恰好完全反应,转移电子数为3NA,C正确;
D. 根据电荷守恒可得n(Na+)+n(H+)=n(Cl-)+n(OH-),n(Na+)+n(H+)=n(F-)+n(OH-),两种溶液中n(Na+)相等,前者是强酸强碱盐,水溶液显中性,后者是强碱弱酸盐,水解使溶液显碱性,所以溶液的pH:NaCl<NaF,故NaCl溶液中n(H+)比NaF的大,因此n(Na+)+n(H+)前者大于后者,则溶液中离子总数:前者大于后者,D正确;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】用惰性电极电解AgNO3溶液,说法不正确的是( )
A.电解过程中阴极质量不断增加
B.电解过程中溶液的pH不断降低
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了达到下列的实验要求,请从供选择的化学试剂或实验方法中选出合适的,将其编号填入对应的空格中,并按要求写出相应的方程式。
供选择的化学试剂或实验方法如下:
A.加入NaOH溶液,过滤、洗涤、干燥
![]() 通入适量的
通入适量的![]()
C.通入![]() 气体
气体
![]() 加入适量铁粉
加入适量铁粉
E.加入![]() 溶液,观察
溶液,观察
![]() 加入澄清石灰水,观察
加入澄清石灰水,观察
G.丁达尔效应
(1)鉴别![]() 胶体和
胶体和![]() 溶液:______;
溶液:______;
(2)除去镁粉中的少量铝粉杂质______;
(3)除去![]() 溶液中
溶液中![]() :______,离子方程式______;
:______,离子方程式______;
(4)实验室保存![]() 溶液时要加入______
溶液时要加入______![]()
(5)除去![]() 溶液中的少量
溶液中的少量![]() 杂质:______。
杂质:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某![]() 样品中含有
样品中含有![]() 和
和![]() 杂质,现欲制取纯净的
杂质,现欲制取纯净的![]() ,某同学设计如图的实验方案。请回答下列问题:
,某同学设计如图的实验方案。请回答下列问题:

(1)操作Ⅰ的名称是______,在该操作中用到的玻璃仪器除了有烧杯、玻璃棒,还有______
(2)沉淀A的成分是______![]() 填化学式
填化学式![]() ,写出第③步反应中铝元素转化的离子方程式______
,写出第③步反应中铝元素转化的离子方程式______
(3)写出证明滤液B中![]() 已沉淀完全的实验方法______
已沉淀完全的实验方法______
(4)不改变上述流程图的结构,将“①过量盐酸”“②过量NaOH”交换位置,则“③过量![]() ”应改为_____,写出此方案下生成沉淀B的离子方程式______
”应改为_____,写出此方案下生成沉淀B的离子方程式______
(5)为了得到更加纯净的![]() ,过滤后需要进行操作步骤是______
,过滤后需要进行操作步骤是______
(6)写出工业由氧化铝冶炼铝的化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成甲、乙两组实验。![]() 、b为弹簧夹,加热及固定装置已略去
、b为弹簧夹,加热及固定装置已略去![]()
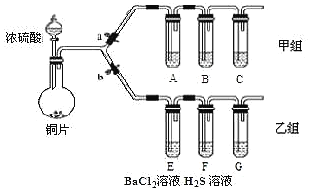
回答下列问题:
(1)制取![]() :写出铜与浓硫酸反应的化学方程式______。
:写出铜与浓硫酸反应的化学方程式______。
(2)用甲组装置验证酸性相对强弱:亚硫酸![]() 碳酸
碳酸![]() 硅酸
硅酸
①操作步骤:连接仪器、______、加药品后,打开a关闭b,然后滴入浓硫酸,加热;
②甲组试管中的试剂分别是:![]() 饱和溶液,B______,C______。试剂B的作用是______。
饱和溶液,B______,C______。试剂B的作用是______。
③能说明酸性:亚硫酸![]() 碳酸
碳酸![]() 硅酸的实验现象是______。
硅酸的实验现象是______。
(3)用乙组装置验证![]() 的某些性质。打开b,关闭a;
的某些性质。打开b,关闭a;
④![]() 溶液中有浅黄色浑浊出现,反应的化学方程式是______。
溶液中有浅黄色浑浊出现,反应的化学方程式是______。![]() 溶液中无明显现象,将其分成a、b两份,
溶液中无明显现象,将其分成a、b两份,
⑤试管a中滴加NaOH溶液,产生白色沉淀的化学式是_______。
⑥试管b中滴加![]() 溶液,也产生白色沉淀,产生白色沉淀的化学式是______。
溶液,也产生白色沉淀,产生白色沉淀的化学式是______。
⑦上述④⑤⑥的反应分别验证![]() 的性质依次是
的性质依次是![]() 填序号
填序号![]() ④______;⑤______;⑥______。
④______;⑤______;⑥______。
A.酸性氧化物的通性![]() 碱性氧化物的通性
碱性氧化物的通性![]() 还原性
还原性![]() 氧化性
氧化性![]() 漂白性。
漂白性。
(4)装置G中盛放的溶液是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可验证同主族元素非金属性的变化规律。
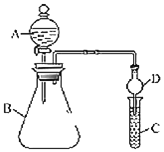
(1)仪器A的名称为______,干燥管D的作用为______。
(2)若要证明非金属性:![]() ,C中为淀粉
,C中为淀粉![]() 碘化钾混合溶液,B中装有
碘化钾混合溶液,B中装有![]() 固体,则A中试剂为______,观察到C中溶液______
固体,则A中试剂为______,观察到C中溶液______![]() 填现象
填现象![]() ,即可证明。从环境保护的观点考虑,此装置缺点______。
,即可证明。从环境保护的观点考虑,此装置缺点______。
(3)若要证明非金属性:![]() ,则在A中______B中加______、C中加______,写出C中反应的化学方程式______
,则在A中______B中加______、C中加______,写出C中反应的化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 环境科学
环境科学![]() 刊发了我国科研部门采用零价铁活化过硫酸钠
刊发了我国科研部门采用零价铁活化过硫酸钠![]() ,其中S为
,其中S为![]() 价
价![]() 去除废水中的正五价砷
去除废水中的正五价砷![]() 的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为
的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为![]() ,
,![]() 。下列叙述正确的是
。下列叙述正确的是![]()
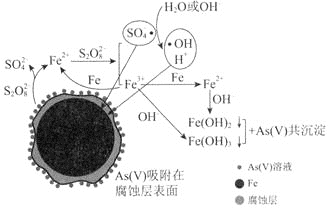
A.![]() 过硫酸钠
过硫酸钠![]() 含
含![]() 个过氧键
个过氧键
B.若![]() 参加反应,共有
参加反应,共有![]() 个
个![]() 被还原
被还原
C.室温下,中间产物![]() 溶于水所得饱和溶液中
溶于水所得饱和溶液中![]() 为
为![]()
D.pH越小,越有利于去除废水中的正五价砷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件下2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2molSO2和1molO2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2molSO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2molSO2和1molO2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2molSO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
A. Q>Q1>Q2B. Q2>Q>Q1C. Q1>Q>Q2D. Q>Q1=Q2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com