
【题目】研究SO2的转化对环境保护具有重要意义。
(1)一种将SO2转化为H2SO4和S的反应为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH
已知SO3(g)+H2O(g)=H2SO4(l) ΔH1=-177 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH2=-297 kJ·mol-1
2SO2(g)+O2(g)=2SO3(g) ΔH3=-197 kJ·mol-1 则ΔH=__________kJ·mol-1。
(2)SO2碱吸收液含NaHSO3和Na2SO3,NaHSO3可用于制取焦亚硫酸钠(Na2S2O5)。一种用SO2碱吸收液和三室膜电解技术制取NaHSO3的装置如图甲所示。已知常温下含硫微粒的物质的量分数如图乙所示,H2SO3的电离平衡常数K1=1.23×10-2、K2=5.6×10-8。
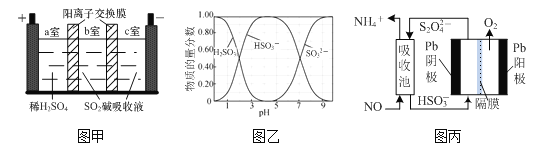
①电解后__________(填“a”、“b”或“c”)室的NaHSO3浓度较大。
②常温下,当SO2碱吸收液的pH=8时,溶液中c(SO32-)∶c(HSO3-)=__________。
③常温下0.1 mol·L-1 NaHSO3溶液中H2SO3、HSO3-、SO32-的物质的量浓度由大到小的顺序是__________。
(3)利用间接电化学法消除NO的原理如图丙所示。
①阴极的电极反应式为__________;
②吸收池每吸收转化1mol NO,阳极区生成标准状况下O2的体积为__________L。
【答案】-254 b 5.6(或28∶5) HSO3-、SO32-、H2SO3 2HSO3-+2e-+2H+=S2O42-+2H2O 28
【解析】
(1)根据盖斯定律书写出正确的方程式,并计算ΔH;
(2)①电解池阳极为稀硫酸溶液,电解质溶液显酸性,电解池阳极发生氧化反应,阳离子向阴极移动,据此分析;
②根据K2=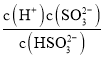 =5.6×10-8及pH=8时c(H+)=10-8mol/L进行计算;
=5.6×10-8及pH=8时c(H+)=10-8mol/L进行计算;
③由图象可知,0.1 molL-1的NaHSO3溶液pH=4呈酸性,亚硫酸氢根离子电离程度大于水解程度;
(3)①阴极发生还原反应,HSO3-被还原为S2O42-,据此书写电极反应;
②电解池的阳极水电离出的OH-放电生成氧气,电极反应为:2H2O-4e-=4H++O2↑,吸收池中NO发生氧化还原反应生成NH4+,有NO~NH4+~5e-,根据电子守恒进行计算。
(1)①SO3(g)+H2O(g)=H2SO4(l) ΔH1=-177 kJ·mol-1;②S(s)+O2(g)=SO2(g) ΔH2=-297 kJ·mol-1;③2SO2(g)+O2(g)=2SO3(g) ΔH3=-197 kJ·mol-1;由盖斯定律可知2①-②+③得反应3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),ΔH=2×(-177 kJ·mol-1)-( -297 kJ·mol-1)+( -197 kJ·mol-1)=-254 kJ·mol-1;
(2)①电解池阳极为稀硫酸溶液,电解质溶液显酸性,电解池阳极发生氧化反应,阳离子向阴极移动,即H+向右侧移动,在b室发生反应:2H++2e-=H2↑ ,所以b室较a室H+浓度升高,因此电解后,b室的NaHSO3浓度增加;
②根据K2=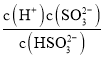 可知,
可知,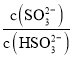 =
=![]() =
=![]() =5.6(或
=5.6(或![]() );
);
③由图象可知,0.1 molL-1的NaHSO3溶液pH=4呈酸性,亚硫酸氢根离子电离程度大于水解程度,因此溶液中H2SO3、HSO3-、SO32-的物质的量浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3);
(3)①阴极发生还原反应,HSO3-被还原为S2O42-,电极反应为:2HSO3-+2e-+2H+=S2O42-+2H2O;
②电解池的阳极水电离出的OH-放电生成氧气,电极反应为:2H2O-4e-=4H++O2↑,吸收池中NO发生氧化还原反应生成NH4+,有NO~NH4+~5e-,当吸收转化1mol NO时,电子转移5mol,根据电子守恒可知当电子转移5mol时,生成氧气的物质的量为![]() =1.25mol,生成氧气的体积为22.4L/mol×1.25mol=28L。
=1.25mol,生成氧气的体积为22.4L/mol×1.25mol=28L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g) ΔH <0并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g) ΔH <0并达到平衡。HI的体积分数随时间的变化如表格所示:
HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
下列说法中正确的是
A. 在条件I下,该反应的平衡常数K=10
B. 在条件I下,从开始反应至5min,用H2表示的反应速率为0.10 mol/(L·min)
C. 在条件II下,到达平衡时, I2(g)的转化率为81.25%
D. 与条件I相比,为达到条件II的数据,可能改变的条件是降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解AgNO3溶液,说法不正确的是( )
A.电解过程中阴极质量不断增加
B.电解过程中溶液的pH不断降低
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示同温度下,pH = 1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且b点溶液的导电性比a点强
B. 图2表示0.1000 mol/L CH3COOH溶液滴定20.00mL0.1000mol/LNaOH溶液所得到的滴定曲线
C. 图3表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息书写相关反应方程式:
(1)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。回收废旧磷酸亚铁锂电池正极片[含Al、炭黑、LiFePO4(难溶于水和碱)]中各物质的流程如下图所示:
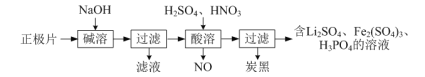
①写出“碱溶”时的离子方程式:________。
②写出“酸溶”时的化学方程式:________。
③LiFePO4可由Fe2O3、碳粉、LiH2PO4在480℃~900℃时混合共热制得,反应中还有CO生成,写出该反应的化学方程式:________。
(2)羟基自由基(电子式为![]() ,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
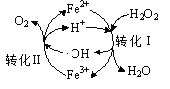
①pH=3时,Fe2+可循环催化H2O2的分解,过程中会产生·OH 中间体,转化过程如右图所示。写出转化Ⅱ的离子方程式:________。
②写出酸性条件下,·OH将水中的乙醛氧化成CO2和H2O的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E是合成农药茚虫威的中间体,其合成路线如下:

(1)写出A→B反应时还需的反应物及条件:__________。
(2)写出化合物D的结构简式:__________。
(3)写出一种符合下列条件的化合物E的同分异构体的结构简式:__________。
Ⅰ.既能发生银镜反应,也能与FeCl3溶液发生显色反应;
Ⅱ.含一个手性碳原子,核磁共振氢谱上有5种峰。
(4)根据已有知识并结合相关信息,写出以![]() 、HOOCCH2COOH、乙醇为原料制备
、HOOCCH2COOH、乙醇为原料制备![]() 的的合成路线流程图________________(无机试剂任用)。
的的合成路线流程图________________(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了达到下列的实验要求,请从供选择的化学试剂或实验方法中选出合适的,将其编号填入对应的空格中,并按要求写出相应的方程式。
供选择的化学试剂或实验方法如下:
A.加入NaOH溶液,过滤、洗涤、干燥
![]() 通入适量的
通入适量的![]()
C.通入![]() 气体
气体
![]() 加入适量铁粉
加入适量铁粉
E.加入![]() 溶液,观察
溶液,观察
![]() 加入澄清石灰水,观察
加入澄清石灰水,观察
G.丁达尔效应
(1)鉴别![]() 胶体和
胶体和![]() 溶液:______;
溶液:______;
(2)除去镁粉中的少量铝粉杂质______;
(3)除去![]() 溶液中
溶液中![]() :______,离子方程式______;
:______,离子方程式______;
(4)实验室保存![]() 溶液时要加入______
溶液时要加入______![]()
(5)除去![]() 溶液中的少量
溶液中的少量![]() 杂质:______。
杂质:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 环境科学
环境科学![]() 刊发了我国科研部门采用零价铁活化过硫酸钠
刊发了我国科研部门采用零价铁活化过硫酸钠![]() ,其中S为
,其中S为![]() 价
价![]() 去除废水中的正五价砷
去除废水中的正五价砷![]() 的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为
的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为![]() ,
,![]() 。下列叙述正确的是
。下列叙述正确的是![]()
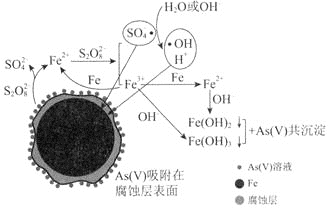
A.![]() 过硫酸钠
过硫酸钠![]() 含
含![]() 个过氧键
个过氧键
B.若![]() 参加反应,共有
参加反应,共有![]() 个
个![]() 被还原
被还原
C.室温下,中间产物![]() 溶于水所得饱和溶液中
溶于水所得饱和溶液中![]() 为
为![]()
D.pH越小,越有利于去除废水中的正五价砷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com