
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As 原子的核外电子排布式_____________。
(2)根据元素周期律,原子半径 Ga_____________As(填“>”或“<”,下同),第一电离能 Ga_____________As。
(3)AsCl3 分子的立体构型为_____________。
(4)锗(Ge)是典型的半导体元素,比较下表中锗卤化物的熔点和沸点,分析其变化规律及原因_____________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约 400 |
【答案】1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 > < 三角锥形 GeCl4、GeBr4、GeI4的熔沸点依次升高;GeCl4、GeBr4、GeI4均为分子晶体,组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高
【解析】
(1)As位于元素周期表中第四周期第VA族,则基态As 原子的核外电子排布式1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3。故答案为:1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;
(2)同一周期元素,原子半径随着原子序数增大而减小,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;Ga位于第四周期第IIIA族、As位于第四周期第VA族,二者位于同一周期,根据元素周期律,原子半径 Ga>As,第一电离能 Ga<As。故答案为:>;<;
(3)AsCl3 分子的中心原子As的价层电子对数=3+![]() =4,As采用sp3杂化,立体构型为三角锥形。故答案为:三角锥形;
=4,As采用sp3杂化,立体构型为三角锥形。故答案为:三角锥形;
(4)锗的卤化物都是分子晶体,分子间通过分子间作用力结合,对于组成与结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高,由于相对分子质量:GeCl4<GeBr4<GeI4,故分子间作用力:GeCl4<GeBr4<GeI4,熔、沸点:GeCl4<GeBr4<GeI4,故答案为:GeCl4、GeBr4、GeI4的熔沸点依次升高;GeCl4、GeBr4、GeI4均为分子晶体,组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】在高温下, Al与Fe2O3发生铝热反应后得到的固体混合物中主要含有Al2O3、Fe,还含有少量Fe2O3。从该样品中固体混合物分离出Al2O3,并回收Fe和Fe2O3的流程如下:

已知:NaAlO2 + CO2 + 2H2O = Al(OH)3↓ + NaHCO3
回答下列问题:
(1)固体①的成分是__________。溶液②的溶质是____________。
(2)加入过量NaOH溶液时,发生反应的离子方程式是__________。
(3)白色固体②与NaOH溶液反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)2SO3(g);ΔH=-196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol。请填写下列空白:
(1)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)_________
A.容器内压强不再发生变化B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化D.容器内气体密度不再发生变化
(2)从反应开始至达到化学平衡,生成SO3平均反应速率为___________;反应放出的热量为_____kJ。
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是______。
A.向容器中通入少量O2B.向容器中通入少量SO2C.使用催化剂D.降低温度E.向容器中通入少量氦气(已知氦气和SO2、O2、SO3都不发生反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物![]() 浓度均为
浓度均为![]() 溶液的pH和原子序数的关系如图所示。
溶液的pH和原子序数的关系如图所示。

![]() 元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
![]() 元素Y和W形成的
元素Y和W形成的![]() 型化合物中含有化学键的类型为______。
型化合物中含有化学键的类型为______。
![]() 短周期元素C、O、S能形成多种化合物,如
短周期元素C、O、S能形成多种化合物,如![]() 、
、![]() 、COS等。
、COS等。
![]() 下列能说明碳、硫两种元素非金属性相对强弱的是______
下列能说明碳、硫两种元素非金属性相对强弱的是______![]() 填序号
填序号![]()
A.S与![]() 发生化合反应比C与
发生化合反应比C与![]() 化合更容易
化合更容易
B.酸性:![]()
C.![]() 中碳元素为
中碳元素为![]() 价,硫元素为
价,硫元素为![]() 价
价
![]() 铅
铅![]() 、锡
、锡![]() 、锗
、锗![]() 与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
![]() 锗的原子序数为______。
锗的原子序数为______。
![]() 它们
它们![]() 价氢氧化物的碱性由强到弱顺序为______
价氢氧化物的碱性由强到弱顺序为______![]() 填化学式
填化学式![]() 。
。
![]() 羰基硫
羰基硫![]() 可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和
可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和![]() 相似。
相似。
![]() 用电子式表示羰基硫
用电子式表示羰基硫![]() 的形成过程:______。
的形成过程:______。
![]() 羰基硫
羰基硫![]() 用氢氧化钠溶液处理及利用的过程如图:
用氢氧化钠溶液处理及利用的过程如图:

已知A是一种正盐,则A的化学式为______;若气体a为单质,反应II的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
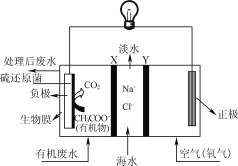
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E分别是铁或铁的化合物。其中D是一种红褐色沉淀。其相互反应关系如图所示:

根据如图所示变化,按要求回答下列问题:
(1)写出A、E的化学式:A__,E__;
(2)写出其中几步反应的化学方程式:
C→B:___;
B→D:___;
E→A:___。
(3)C中加入NaOH溶液,看到的现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物在化工、医药、材料等领域有着广泛的应用,回答下列问题:
(1)参照下图 B、F 元素的位置,依据第二周期元素第一电离能的变化规律,用小黑点标出 C、N、O 三 种元素的相对位置。
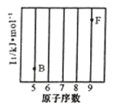
(2)碳的一种单质的结构如图(a)所示,则碳原子的杂化轨道类型为_________________ 。
(3)二卤化铅 PbX2 的熔点如图(b)所示,可推断:依 F、Cl、Br、I 次序,PbX2 中的化学键 的离子性_____( 填“增 强”、“ 不变”或“减弱”, 下 同 ), 共价性_____。
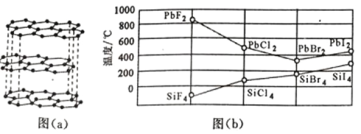
(4)NH3 和 F2 在 Cu 催化下可发生反应 4NH3+3F2 ![]() NF3+3NH4F,化学方程式中的 5 种物质所属的晶体 类型有_____(填序号)。写出基态铜原子的价电子排布式_____。
NF3+3NH4F,化学方程式中的 5 种物质所属的晶体 类型有_____(填序号)。写出基态铜原子的价电子排布式_____。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
(5)BF3 与一定量水形成(H2O)2·BF3 晶体 Q,Q 在一定条件下可转化为 R: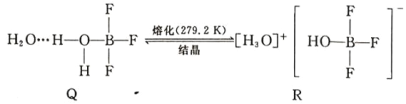 晶体 R 中含有的化学键包 括_____。
晶体 R 中含有的化学键包 括_____。
(6)水杨酸第一级电离形成离子![]() ,相同温度下,水杨酸的 Ka2____________________________苯酚
,相同温度下,水杨酸的 Ka2____________________________苯酚
(![]() )的 Ka(填“>”“ =”或“<”),其原因是______________。
)的 Ka(填“>”“ =”或“<”),其原因是______________。
(7)碳的另一种单质 C60 可以与钾形成低温超导化合物,晶体结构如图(c)所示,K 位于立方体的棱上和 立方体的内部,此化合物的化学式为____________;其晶胞参数为 1.4 nm,阿伏加德罗常数用 NA 表 示,则晶体的密度为________________g·cm-3。(只需列出式子)
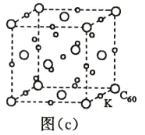
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-= AlO2-+H2↑
B.过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com