
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物![]() 浓度均为
浓度均为![]() 溶液的pH和原子序数的关系如图所示。
溶液的pH和原子序数的关系如图所示。

![]() 元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
![]() 元素Y和W形成的
元素Y和W形成的![]() 型化合物中含有化学键的类型为______。
型化合物中含有化学键的类型为______。
![]() 短周期元素C、O、S能形成多种化合物,如
短周期元素C、O、S能形成多种化合物,如![]() 、
、![]() 、COS等。
、COS等。
![]() 下列能说明碳、硫两种元素非金属性相对强弱的是______
下列能说明碳、硫两种元素非金属性相对强弱的是______![]() 填序号
填序号![]()
A.S与![]() 发生化合反应比C与
发生化合反应比C与![]() 化合更容易
化合更容易
B.酸性:![]()
C.![]() 中碳元素为
中碳元素为![]() 价,硫元素为
价,硫元素为![]() 价
价
![]() 铅
铅![]() 、锡
、锡![]() 、锗
、锗![]() 与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
![]() 锗的原子序数为______。
锗的原子序数为______。
![]() 它们
它们![]() 价氢氧化物的碱性由强到弱顺序为______
价氢氧化物的碱性由强到弱顺序为______![]() 填化学式
填化学式![]() 。
。
![]() 羰基硫
羰基硫![]() 可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和
可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和![]() 相似。
相似。
![]() 用电子式表示羰基硫
用电子式表示羰基硫![]() 的形成过程:______。
的形成过程:______。
![]() 羰基硫
羰基硫![]() 用氢氧化钠溶液处理及利用的过程如图:
用氢氧化钠溶液处理及利用的过程如图:

已知A是一种正盐,则A的化学式为______;若气体a为单质,反应II的离子方程式为______。
【答案】第三周期第ⅦA族 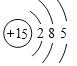 离子键、非极性共价键 AC 32
离子键、非极性共价键 AC 32 ![]()
![]()
![]()
![]()
【解析】
浓度均为0.01mol/L的溶液,X、R的最高价氧化物对应的水化物pH=2,X、R的最高价氧化物的水化物为一元强酸,Y的最高价氧化物对应的水化物pH=12,Y的最高价氧化物的水化物为一元强碱,Z的最高价氧化物的水化物的pH>2且溶液呈酸性,Z的最高价氧化物的水化物为弱酸,W的最高价氧化物的水化物的pH<2,W的最高价氧化物的水化物为多元强酸,结合原子序数的关系,所以X、Y、Z、W、R分别为N、Na、P、S、Cl元素。
![]() 元素Cl在周期表中的位置是第三周期第ⅦA族,磷原子结构示意图为
元素Cl在周期表中的位置是第三周期第ⅦA族,磷原子结构示意图为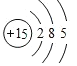 ,
,
故答案为:第三周期第ⅦA族; ;
;
![]() 元素Y和W形成的
元素Y和W形成的![]() 型化合物为
型化合物为![]() ,其电子式为:
,其电子式为:![]() ,含有离子键、非极性共价键,
,含有离子键、非极性共价键,
故答案为:离子键、非极性共价键;
II(1)A.S与H2发生化合反应比C与H2化合更容易,能证明非金属性![]() ,故A正确;
,故A正确;
B.酸性:![]() ,由于亚硫酸不是S元素的最高价氧化物对应的水化物,无法比较二者的非金属性大小,故B错误;
,由于亚硫酸不是S元素的最高价氧化物对应的水化物,无法比较二者的非金属性大小,故B错误;
C.CS2中碳元素为![]() 价,硫元素为
价,硫元素为![]() 价,说明硫原子对共用电子对的吸引力较强,说明非金属性:
价,说明硫原子对共用电子对的吸引力较强,说明非金属性:![]() ,故C正确;
,故C正确;
故答案为:AC;
(2)①锗在硅元素的下一周期,二者原子序数之差为18,故锗的原子序数为![]() ,
,
故答案为:32;
②同主族自上而下金属性增强,金属性越强,它们![]() 价氢氧化物的碱性越强,故碱性由强到弱顺序为:
价氢氧化物的碱性越强,故碱性由强到弱顺序为:![]() ,
,
故答案为:![]() ;
;
(3)①COS分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,则C与O、C与S均形成两对共用电子对,用电子式表示羰基硫分子的形成过程为![]() ,
,
故答案为:![]() ;
;
![]() 由图示可知生成正盐为
由图示可知生成正盐为![]() ,由元素守恒可知,生成正盐还有
,由元素守恒可知,生成正盐还有![]() ,反应为
,反应为![]() ,硫化钠与水反应生成
,硫化钠与水反应生成![]() ,S元素的化合价升高,则生成的气体a为还原产物氢气,结合原子守恒还有氢氧化钠生成,其反应的离子方程式为:
,S元素的化合价升高,则生成的气体a为还原产物氢气,结合原子守恒还有氢氧化钠生成,其反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是短周期元素中的四种非金属元素,它们的原子序数依次增大。X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出元素符号:Y__Z____W____。
(2)在一定条件下,由X单质与Z单质反应生成E,E在催化剂存在的条件下,可用于还原汽车尾气中的____,以减少对大气的污染。
(3)由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为____。
(4)工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式____。该反应中被氧化的E与参与反应的E的质量之比___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】巨豆三烯酮(F)是一种重要的香料,其合成路线如下:
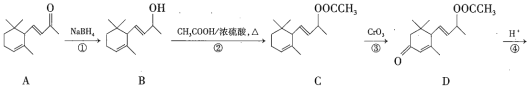
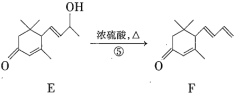
(1)化合物F的分子式为_____________,1mol该物质完全燃烧需消耗________molO2。
(2)在上述转化过程中,反应②的目的是______________,写出反应②的化学方程式:_______________。
(3)下列说法正确的是___________(填序号)。
A.化合物A~F均属于芳香烃的衍生物 B.反应①属于还原反应
C.1mol化合物D可以跟4molH2发生反应 D.化合物F中所含官能团的名称为碳碳双键、羰基
(4)符合下列条件的D的同分异构体有两种,其中一种同分异构体的结构简式如下图所示,请写出另一种同分异构体的结构简式:__________________。
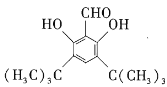
a.属于芳香化合物 b.核磁共振氢谱显示,分子中有4种不同类型的氢原子
c. 1mol该物质最多可消耗2mol NaOH d.能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1mol/L①CH3COOH、②NaOH、③CH3COONa,下列叙述正确的是( )
A.①中[CH3COOH]>[CH3COO-]>[H+]>[OH-]
B.①②等体积混合后,醋酸根离子浓度小于③的二分之一
C.①③等体积混合以后,溶液呈酸性,则(Na+)>(CH3COO-)>(H+)
D.①②等体积混合以后,水的电离程度比①③等体积混合的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如下图所示装置,一次实验即可达到目的(不必选用其他酸性物质)。
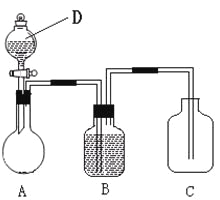
请据此实验回答下列问题:
(1)仪器D的名称是____________,所盛放的试剂应为___________(填化学式);
(2)在烧瓶中装某可溶性正盐溶液,则A中反应的离子方程式是______________;
(3)装置B中所盛的试剂是_____________,其作用是___________________;
(4)装置C中所盛的试剂是________,C中反应的化学方程式是____________;
(5)根据该实验可以得出C6H5OH、H2CO3、CH3COOH这三种物质的酸性强弱顺序为
______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As 原子的核外电子排布式_____________。
(2)根据元素周期律,原子半径 Ga_____________As(填“>”或“<”,下同),第一电离能 Ga_____________As。
(3)AsCl3 分子的立体构型为_____________。
(4)锗(Ge)是典型的半导体元素,比较下表中锗卤化物的熔点和沸点,分析其变化规律及原因_____________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约 400 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡HIn(aq,红色) ![]() H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
A. ④⑤B. ③⑤C. ①④D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种红棕色金属氧化物;B、D是金属单质;J是一种难溶于水的白色化合物,受热易分解。
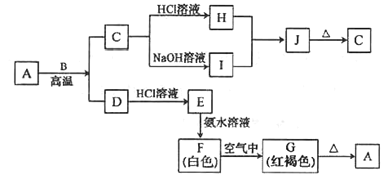
回答下列问题:
(1)A、E、J、G的化学式分别为___、___、___、___。
(2)C转化为I的离子方程式为___。
(3)H和I反应生成J的离子方程式为___。
(4)如何检验E溶液中大量存在的阳离子?___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ag2O2是银锌碱性电池的正极活性物质,用如下方法制备:在过量KOH溶液中加入适量AgNO3溶液,生成Ag2O沉淀;保持反应温度为80℃,再边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中。反应完全后,过滤、洗涤、真空干燥就可得到固体样品。整个制备过程可用下列化学反应方程式描述:2AgNO3+4KOH+K2S2O8 ![]() Ag2O2↓+2KNO3 +2K2SO4+2H2O。在上述制备过程中,沉淀表面吸附物质不含有( )
Ag2O2↓+2KNO3 +2K2SO4+2H2O。在上述制备过程中,沉淀表面吸附物质不含有( )
A. KNO3B. K2SO4C. KOHD. AgNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com