
【题目】为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如下图所示装置,一次实验即可达到目的(不必选用其他酸性物质)。
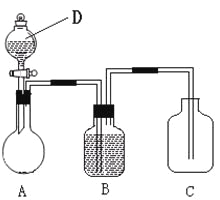
请据此实验回答下列问题:
(1)仪器D的名称是____________,所盛放的试剂应为___________(填化学式);
(2)在烧瓶中装某可溶性正盐溶液,则A中反应的离子方程式是______________;
(3)装置B中所盛的试剂是_____________,其作用是___________________;
(4)装置C中所盛的试剂是________,C中反应的化学方程式是____________;
(5)根据该实验可以得出C6H5OH、H2CO3、CH3COOH这三种物质的酸性强弱顺序为
______________________。
【答案】分液漏斗 CH3COOH 2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ 饱和NaHCO3溶液 除去CO2气体中混有的醋酸杂质 苯酚钠溶液 C6H5ONa+H2O+CO2=C6H5OH+NaHCO3 CH3COOH>H2CO3>C6H5OH
【解析】
根据强酸制取弱酸知中,强酸能和弱酸盐反应生成弱酸(酸相对强弱),弱酸能制取更弱的酸,要想验证C6H5OH、H2CO3、CH3COOH的酸性强弱,用CH3COOH和碳酸盐反应制取二氧化碳,用二氧化碳和苯酚的可溶性盐制取苯酚,根据实验现象确定酸的相对强弱。
(1)仪器D为分液漏斗,应盛放CH3COOH,以CH3COOH与碳酸盐反应生成二氧化碳,证明CH3COOH酸性强于碳酸酸性;
(2)用CH3COOH和在烧瓶中装的某可溶性正盐溶液反应制取二氧化碳,醋酸是弱酸,应该写化学式,发生反应的离子反应方程式为2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑;
(3)醋酸有挥发性,使得反应产生的CO2气体中含有醋酸,对实验造成干扰,因此B装置要盛放能除去醋酸,且不与CO2反应,也不能产生新的杂质的物质,一般常用饱和碳酸氢钠溶液;
(4)CO2和苯酚钠溶液反应生成不溶性的苯酚,所以C选用苯酚钠溶液,反应方程式为C6H5ONa+H2O+CO2=C6H5OH+NaHCO3;
(5)由于CH3COOH能与碳酸盐反应生成二氧化碳,说明酸性:CH3COOH>H2CO3;二氧化碳能与苯酚钠反应生成C6H5OH,说明酸性:H2CO3>C6H5OH;所以酸性有强到弱的顺序为:CH3COOH>H2CO3>C6H5OH。


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.乙酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O
B.醋酸溶液与氢氧化铜反应:2CH3COOH+Cu(OH)2![]() Cu2++2CH3COO-+2H2O
Cu2++2CH3COO-+2H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O![]() 2C6H5OH+CO32-
2C6H5OH+CO32-
D.甲酸溶液与足量的银氨溶液共热:HCOOH+4[Ag(NH3)2]++4OH-![]() CO32-+2NH4++4Ag↓+6NH3+2H2O
CO32-+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
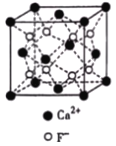
【题目】[化学—选修3:物质结构与性质]国务院批复通过的《全国矿产资源规划(2016﹣﹣2020年)》中,首次将萤石等24种矿产列入战略性矿产目录。萤石为氟化钙的俗名,其重要用途是生产氢氟酸。
(1)基态F原子核外电子共有_____种运动状态,基态Ca2+的最外层电子排布图为_____。
(2)实验室制氟化氢是用萤石与浓硫酸反应,但该反应不可以在玻璃器皿中进行,请用化学反应方程式解释原因_____,该反应涉及的元素电负性最大的是_____(用元素符号表示)。该反应的产物之一会与反应物继续反应生成H2SiF6,则H2SiF6分子的中心原子价层电子对数为_____。
(3)CaF2与CaCl2熔点比较低的物质是_____,原因是_______________。CaF2晶胞如图,其中Ca2+的配位数为_____。在CaF2晶体中Ca2+的离子半径为a cm,F﹣的离子半径为bcm;则CaF2的密度为_____gcm﹣3(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,质量为m的气体A与质量为n的气体B的分子数相同,下列说法中不正确的是( )
A.气体A与气体B的相对分子质量比为m:n
B.同质量气体A与气体B的分子个数比为n:m
C.同温同压下,A气体与B气体的密度比为n:m
D.相同状况下,同体积的A气体与B气体的质量比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成氧化铜,氧化铜再与硝酸反应。下列叙述正确的是( )
A.三种途径所消耗的铜的物质的量不相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗铜的物质的量是:途径③>途径①>途径②
D.所消耗硝酸的物质的量是:途径①>途径②>途径③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物![]() 浓度均为
浓度均为![]() 溶液的pH和原子序数的关系如图所示。
溶液的pH和原子序数的关系如图所示。

![]() 元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
![]() 元素Y和W形成的
元素Y和W形成的![]() 型化合物中含有化学键的类型为______。
型化合物中含有化学键的类型为______。
![]() 短周期元素C、O、S能形成多种化合物,如
短周期元素C、O、S能形成多种化合物,如![]() 、
、![]() 、COS等。
、COS等。
![]() 下列能说明碳、硫两种元素非金属性相对强弱的是______
下列能说明碳、硫两种元素非金属性相对强弱的是______![]() 填序号
填序号![]()
A.S与![]() 发生化合反应比C与
发生化合反应比C与![]() 化合更容易
化合更容易
B.酸性:![]()
C.![]() 中碳元素为
中碳元素为![]() 价,硫元素为
价,硫元素为![]() 价
价
![]() 铅
铅![]() 、锡
、锡![]() 、锗
、锗![]() 与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
![]() 锗的原子序数为______。
锗的原子序数为______。
![]() 它们
它们![]() 价氢氧化物的碱性由强到弱顺序为______
价氢氧化物的碱性由强到弱顺序为______![]() 填化学式
填化学式![]() 。
。
![]() 羰基硫
羰基硫![]() 可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和
可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和![]() 相似。
相似。
![]() 用电子式表示羰基硫
用电子式表示羰基硫![]() 的形成过程:______。
的形成过程:______。
![]() 羰基硫
羰基硫![]() 用氢氧化钠溶液处理及利用的过程如图:
用氢氧化钠溶液处理及利用的过程如图:

已知A是一种正盐,则A的化学式为______;若气体a为单质,反应II的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。请回答:
![]() 基态铜原子的电子排布式为 ______ ;从铜原子价层电子结构变化角度来看,高温时CuO与
基态铜原子的电子排布式为 ______ ;从铜原子价层电子结构变化角度来看,高温时CuO与![]() 的稳定性是CuO ______
的稳定性是CuO ______ ![]() 填写“
填写“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ______ ,若“
硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ______ ,若“![]() ”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se ______
”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se ______ ![]() 填“
填“![]() ”、“
”、“![]() ”
”![]() 。
。
![]() 常温下白色晶体,熔点为
常温下白色晶体,熔点为![]() ,
,![]() 时升华,则
时升华,则![]() 固体的晶体类型为 ______ ;
固体的晶体类型为 ______ ;![]() 分子中Se原子的杂化类型为 ______ 。
分子中Se原子的杂化类型为 ______ 。
![]() 镓元素在元素周期表中的位置是 ______ ,该族元素都具有缺电子性
镓元素在元素周期表中的位置是 ______ ,该族元素都具有缺电子性![]() 价电子数少于价层轨道数
价电子数少于价层轨道数![]() ,其化合物可与具有孤对电子的分子或离子生成配合物,如
,其化合物可与具有孤对电子的分子或离子生成配合物,如![]() 能与
能与![]() 反应生成BF3·NH3,BF3·NH3的结构简式可表示为 ______ 。
反应生成BF3·NH3,BF3·NH3的结构简式可表示为 ______ 。
![]() 金刚砂
金刚砂![]() 的晶胞结构如图所示:
的晶胞结构如图所示:
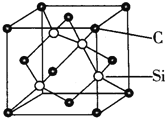
则在SiC中,每个C原子周围紧邻的C原子数目为 ______ 个;若晶胞的边长为apm,则金刚砂的密度为 ______ ![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL0.2mol·L-1的Na2SO4溶液。回答下列问题:
(1)填写下列实验操作步骤中的空白处:
A.在天平上称取___gNa2SO4固体,把它放在___中,用适量的蒸馏水溶解;
B.把制得的溶液小心地沿着___注入___中;
C.继续向容量瓶中加入蒸馏水至液面离容量瓶颈刻度线下1~2cm时,改用___小心滴加蒸馏水至溶液凹液面最低处与刻度线水平相切;
D.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中,并轻轻摇匀;
E.盖好瓶塞,反复上下颠倒,摇匀。
(2)第(1)题中操作步骤的正确顺序是(填标号)___。
(3)下列情况中,会使所配溶液浓度偏高的是___(填标号)。
a.溶解搅拌时有部分液体溅出
b.加蒸馏水时,不慎超过了刻度线
C.在定容时,俯视刻度线
d.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X和Y的核电荷数都小于18,最外层电子数分别为n和(m-5),次外层分别有(n+2)个和m个电子。甲和乙分别为元素X、Y的最高价氧化物的水化物。
(1)元素名称X为____________________,Y为____________________。
(2)甲的化学式是____________________,乙的化学式是____________________。
(3)甲与乙反应的离子方程式是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com