
【题目】[化学—选修3:物质结构与性质]国务院批复通过的《全国矿产资源规划(2016﹣﹣2020年)》中,首次将萤石等24种矿产列入战略性矿产目录。萤石为氟化钙的俗名,其重要用途是生产氢氟酸。
(1)基态F原子核外电子共有_____种运动状态,基态Ca2+的最外层电子排布图为_____。
(2)实验室制氟化氢是用萤石与浓硫酸反应,但该反应不可以在玻璃器皿中进行,请用化学反应方程式解释原因_____,该反应涉及的元素电负性最大的是_____(用元素符号表示)。该反应的产物之一会与反应物继续反应生成H2SiF6,则H2SiF6分子的中心原子价层电子对数为_____。
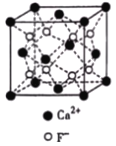
(3)CaF2与CaCl2熔点比较低的物质是_____,原因是_______________。CaF2晶胞如图,其中Ca2+的配位数为_____。在CaF2晶体中Ca2+的离子半径为a cm,F﹣的离子半径为bcm;则CaF2的密度为_____gcm﹣3(设阿伏加德罗常数的值为NA)。
【答案】9 ![]() SiO2+4HF=SiF4↑+2H2O F 6 CaCl2 二者均为离子晶体,Cl﹣半径大于F-,则CaCl2的晶格能大于CaF2的晶格能 8
SiO2+4HF=SiF4↑+2H2O F 6 CaCl2 二者均为离子晶体,Cl﹣半径大于F-,则CaCl2的晶格能大于CaF2的晶格能 8 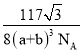
【解析】
(1)基态F原子含有9个核外电子,每个电子的运动状态不同;基态Ca2+的排布式为1s22s22p63s23p6;
(2)氢氟酸能与二氧化硅反应生成四氟化硅气体和水;反应涉及元素有H、O、F、Si;H2SiF6与SiF62-中心原子价层电子对数相同;
(3)离子晶体,离子半径越小,晶格能越大,熔点越高; 根据晶胞结构,一个Ca2+离子距离相等且最近的F-有8个;根据ρ=![]() 计算。
计算。
(1)基态F原子含有9个核外电子,每个电子的运动状态不同,则有9种种运动状态;基态Ca2+的排布式为1s22s22p63s23p6,最外层为第三层,则排布图为![]() ;
;
(2)氢氟酸能与二氧化硅反应生成四氟化硅气体和水,方程式为SiO2+4HF=SiF4↑+2H2O;反应涉及元素有H、O、F、Si,电负性最大的为F;H2SiF6与SiF62-中心原子价层电子对数相同,则中心Si原子的孤电子对数=![]() (4+2-1×6)=0,无孤电子对,只含有6条共价键,则中心原子价层电子对数为6;
(4+2-1×6)=0,无孤电子对,只含有6条共价键,则中心原子价层电子对数为6;
(3)CaF2与CaCl2均为离子晶体, r(F-)<r(Cl-),离子半径越小,晶格能越大,熔点越高,则CaCl2的熔点较低; 根据晶胞结构,一个F-周围距离最近且相等的Ca2+离子有4个,则一个Ca2+离子距离相等且最近的F-有8个,则配位数为8;Ca2+在顶点和面心,N(Ca2+)=8×![]() +6×
+6×![]() =4,F-在晶胞内,个数为8,根据晶胞结构,体对角线=4×(a+b),则V=
=4,F-在晶胞内,个数为8,根据晶胞结构,体对角线=4×(a+b),则V=![]() ,
,![]() =
=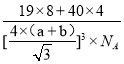 =
=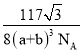 。
。


科目:高中化学 来源: 题型:
【题目】金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
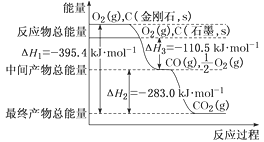
(1)在通常状况下,金刚石和石墨相比较,___(填“金刚石”或“石墨”)更稳定。
(2)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497kJ·mol-1。N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol-1。NO分子中化学键的键能为___kJ·mol-1。
(3)综合上述有关信息,请写出用CO除去NO的热化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸中,混合物完全溶解,当再加入250mL 2.00mol/L的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为( )
A. 1.00 mol/LB. 0.500 mol/L
C. 2.00 mol/LD. 3.00 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M的球棍模型如图所示:
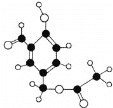
(1)请写出物质M的分子式_______含氧官能团名称_________
(2)M在一定条件下,可以发生水解反应,生成A、B两种物质(它们的相对分子质量关系A>B)。B可以用以下方法制得:X![]() Y
Y![]() Z
Z![]() W
W![]() B。其中W能发生银镜反应。则I属于________反应(填反应类型)
B。其中W能发生银镜反应。则I属于________反应(填反应类型)
(3)写出反应Ⅱ的化学方程式:_____。反应Ⅲ的化学方程式:________。
(4)1molA分别与Na、NaOH溶液反应,所用Na、NaOH物质的量的最大值之比是_______。
(5)A有多种同分异构体,符合下列三个件的同分异构体有_______种,其中分子结构中只有六种氢原子的结构简式为__________
a.环上只有两个取代基
b.与FeCl3溶液显紫色;
c.能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期主族元素,X与Y位于同一主族,X与W能够形成多种化合物,其中一种为红棕色气体,Y与Z形成的一种化合物Y2Z2的分子结构模型为![]() 。下列叙述正确的是( )
。下列叙述正确的是( )
A.X与W、Y及Z均能组合成多种化合物B.简单离子半径:Y>Z>X>W
C.W的氧化物的水化物一定为强酸D.化合物Y2Z2中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】巨豆三烯酮(F)是一种重要的香料,其合成路线如下:
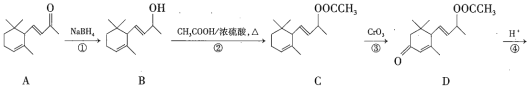
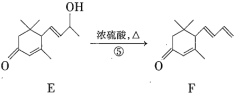
(1)化合物F的分子式为_____________,1mol该物质完全燃烧需消耗________molO2。
(2)在上述转化过程中,反应②的目的是______________,写出反应②的化学方程式:_______________。
(3)下列说法正确的是___________(填序号)。
A.化合物A~F均属于芳香烃的衍生物 B.反应①属于还原反应
C.1mol化合物D可以跟4molH2发生反应 D.化合物F中所含官能团的名称为碳碳双键、羰基
(4)符合下列条件的D的同分异构体有两种,其中一种同分异构体的结构简式如下图所示,请写出另一种同分异构体的结构简式:__________________。
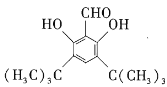
a.属于芳香化合物 b.核磁共振氢谱显示,分子中有4种不同类型的氢原子
c. 1mol该物质最多可消耗2mol NaOH d.能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.
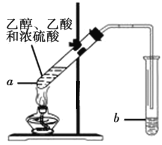 ℃
℃
(1)写出实验室制备乙酸乙酯的化学方程式_________
(2)步骤②中b试管中饱和Na2CO3溶液的主要作用_______(填字母)
a.降低乙酸乙酯的溶解度
b.除去实验中挥发出来的硫酸
c.除去乙酸乙酯中混有的乙酸和乙醇
(3)试管b中盛放的试剂_________(填“能”或“不能”)换成NaOH溶液
(4)连接好装置(装置气密性良好),用小火均匀地加热装有混合液的试管a3~5min,需要用小火均匀加热,其主要原因是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如下图所示装置,一次实验即可达到目的(不必选用其他酸性物质)。
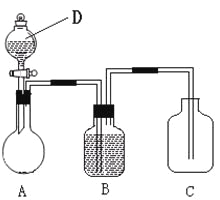
请据此实验回答下列问题:
(1)仪器D的名称是____________,所盛放的试剂应为___________(填化学式);
(2)在烧瓶中装某可溶性正盐溶液,则A中反应的离子方程式是______________;
(3)装置B中所盛的试剂是_____________,其作用是___________________;
(4)装置C中所盛的试剂是________,C中反应的化学方程式是____________;
(5)根据该实验可以得出C6H5OH、H2CO3、CH3COOH这三种物质的酸性强弱顺序为
______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A含碳76.6%,氢6.4%,氧17%,它的相对分子质量约为甲烷的5.9倍,求该有机物的分子式___________。在常温下,该有机物可与溴水反应生成白色沉淀,0.5mol恰好与1.5molBr2作用,据此确定该有机物的结构简式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com