
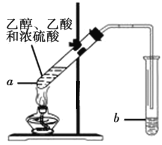
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.
 ℃
℃
(1)写出实验室制备乙酸乙酯的化学方程式_________
(2)步骤②中b试管中饱和Na2CO3溶液的主要作用_______(填字母)
a.降低乙酸乙酯的溶解度
b.除去实验中挥发出来的硫酸
c.除去乙酸乙酯中混有的乙酸和乙醇
(3)试管b中盛放的试剂_________(填“能”或“不能”)换成NaOH溶液
(4)连接好装置(装置气密性良好),用小火均匀地加热装有混合液的试管a3~5min,需要用小火均匀加热,其主要原因是________
【答案】CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O a、c 不能 减少原料损失,减少副产物
CH3COOCH2CH3+H2O a、c 不能 减少原料损失,减少副产物
【解析】
实验室用乙酸和乙醇在浓硫酸加热条件下反应生成乙酸乙酯,用饱和碳酸钠溶液除去乙酸和乙醇,并降低乙酸乙酯的溶解度,增大水的密度,使酯浮于水面,容易分层析出,便于分离,据此分析解答。
(1)实验室用乙酸和乙醇在浓硫酸加热条件下反应生成乙酸乙酯,化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(2)根据分析,b试管中饱和Na2CO3溶液除去乙酸和乙醇,并降低乙酸乙酯的溶解度,增大水的密度,使酯浮于水面,容易分层析出,便于分离,答案选a、c;
(3)试管b中盛放的试剂不能换成NaOH溶液,因为碱性条件下生成的乙酸乙酯会发生水解;
(4)乙酸和乙醇具有挥发性,温度过高会增大原料损失,同时高温下乙醇在浓硫酸作用下会发生分子间脱水生成乙醚或发生消去反应生成乙烯,导致副产物增多,则需要用小火均匀加热的原因是减少原料损失,减少副产物。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
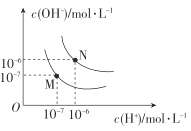
【题目】浓度均为0.01molL-1的盐酸(A)、醋酸溶液(B)、氢氧化钠溶液(C):
(1)写出B溶液中醋酸的电离方程式:______________。上述溶液稀释10倍后pH减小的是______________(填字母)。
(2)取等体积的A、B两溶液分别加入过量的锌粉,反应开始时放出H2的速率依次为a1、a2,则a1______________(填“>”“<”或“=”,下同)a2。反应结束时放出H2的物质的量为n1、n2,则n1______________n2。
(3)完全中和体积与物质的量浓度均相同的两份C溶液时,需A、B两溶液的体积依次为V1、V2则V1______________V2;若完全中和体积与pH均相同的A、B两溶液时消耗C溶液的体积分别为V(A)、V(B),则V(A)______________V(B)。
(4)图中M点表示25℃时水在电离平衡时的离子浓度N点表示T℃时水在电离平衡时的离子浓度。T℃时,3×10-3molL-1的氢氧化钠溶液与1×10-3molL-1盐酸等体积混合后溶液的pH=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应: xA(g)+yB(s)![]() zC(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是( )。
zC(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是( )。
A.x+y>zB.平衡向正反应方向移动C.B的转化率增大D.C的体积分数下降
查看答案和解析>>
科目:高中化学 来源: 题型:
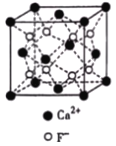
【题目】[化学—选修3:物质结构与性质]国务院批复通过的《全国矿产资源规划(2016﹣﹣2020年)》中,首次将萤石等24种矿产列入战略性矿产目录。萤石为氟化钙的俗名,其重要用途是生产氢氟酸。
(1)基态F原子核外电子共有_____种运动状态,基态Ca2+的最外层电子排布图为_____。
(2)实验室制氟化氢是用萤石与浓硫酸反应,但该反应不可以在玻璃器皿中进行,请用化学反应方程式解释原因_____,该反应涉及的元素电负性最大的是_____(用元素符号表示)。该反应的产物之一会与反应物继续反应生成H2SiF6,则H2SiF6分子的中心原子价层电子对数为_____。
(3)CaF2与CaCl2熔点比较低的物质是_____,原因是_______________。CaF2晶胞如图,其中Ca2+的配位数为_____。在CaF2晶体中Ca2+的离子半径为a cm,F﹣的离子半径为bcm;则CaF2的密度为_____gcm﹣3(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A充分燃烧消耗氧气的量不相等的是(填序号)_______。
A. C7H12O2 B.C6H14 C.C6H14O D. C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种,则A的结构简式为_____________。
(3)若链烃A的分子结构中有三种氢原子,个数比为3:2:1,则A的名称为________。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,质量为m的气体A与质量为n的气体B的分子数相同,下列说法中不正确的是( )
A.气体A与气体B的相对分子质量比为m:n
B.同质量气体A与气体B的分子个数比为n:m
C.同温同压下,A气体与B气体的密度比为n:m
D.相同状况下,同体积的A气体与B气体的质量比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成氧化铜,氧化铜再与硝酸反应。下列叙述正确的是( )
A.三种途径所消耗的铜的物质的量不相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗铜的物质的量是:途径③>途径①>途径②
D.所消耗硝酸的物质的量是:途径①>途径②>途径③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。请回答:
![]() 基态铜原子的电子排布式为 ______ ;从铜原子价层电子结构变化角度来看,高温时CuO与
基态铜原子的电子排布式为 ______ ;从铜原子价层电子结构变化角度来看,高温时CuO与![]() 的稳定性是CuO ______
的稳定性是CuO ______ ![]() 填写“
填写“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ______ ,若“
硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ______ ,若“![]() ”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se ______
”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se ______ ![]() 填“
填“![]() ”、“
”、“![]() ”
”![]() 。
。
![]() 常温下白色晶体,熔点为
常温下白色晶体,熔点为![]() ,
,![]() 时升华,则
时升华,则![]() 固体的晶体类型为 ______ ;
固体的晶体类型为 ______ ;![]() 分子中Se原子的杂化类型为 ______ 。
分子中Se原子的杂化类型为 ______ 。
![]() 镓元素在元素周期表中的位置是 ______ ,该族元素都具有缺电子性
镓元素在元素周期表中的位置是 ______ ,该族元素都具有缺电子性![]() 价电子数少于价层轨道数
价电子数少于价层轨道数![]() ,其化合物可与具有孤对电子的分子或离子生成配合物,如
,其化合物可与具有孤对电子的分子或离子生成配合物,如![]() 能与
能与![]() 反应生成BF3·NH3,BF3·NH3的结构简式可表示为 ______ 。
反应生成BF3·NH3,BF3·NH3的结构简式可表示为 ______ 。
![]() 金刚砂
金刚砂![]() 的晶胞结构如图所示:
的晶胞结构如图所示:
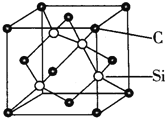
则在SiC中,每个C原子周围紧邻的C原子数目为 ______ 个;若晶胞的边长为apm,则金刚砂的密度为 ______ ![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是
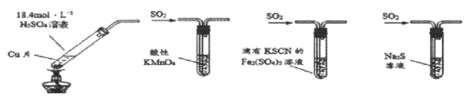
A.若将甲中上层清液倒入水中,观察到溶液呈蓝色,说明有CuSO4生成
B.图乙装置中溶液的颜色变浅,说明SO2具有漂白性
C.图丙装置中溶液的颜色变浅,说明SO2具有还原性
D.图丁装置中产生淡黄色沉淀,说明SO2或H2SO3具有氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com