
【题目】某有机物A含碳76.6%,氢6.4%,氧17%,它的相对分子质量约为甲烷的5.9倍,求该有机物的分子式___________。在常温下,该有机物可与溴水反应生成白色沉淀,0.5mol恰好与1.5molBr2作用,据此确定该有机物的结构简式_____________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
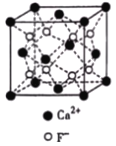
【题目】[化学—选修3:物质结构与性质]国务院批复通过的《全国矿产资源规划(2016﹣﹣2020年)》中,首次将萤石等24种矿产列入战略性矿产目录。萤石为氟化钙的俗名,其重要用途是生产氢氟酸。
(1)基态F原子核外电子共有_____种运动状态,基态Ca2+的最外层电子排布图为_____。
(2)实验室制氟化氢是用萤石与浓硫酸反应,但该反应不可以在玻璃器皿中进行,请用化学反应方程式解释原因_____,该反应涉及的元素电负性最大的是_____(用元素符号表示)。该反应的产物之一会与反应物继续反应生成H2SiF6,则H2SiF6分子的中心原子价层电子对数为_____。
(3)CaF2与CaCl2熔点比较低的物质是_____,原因是_______________。CaF2晶胞如图,其中Ca2+的配位数为_____。在CaF2晶体中Ca2+的离子半径为a cm,F﹣的离子半径为bcm;则CaF2的密度为_____gcm﹣3(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。请回答:
![]() 基态铜原子的电子排布式为 ______ ;从铜原子价层电子结构变化角度来看,高温时CuO与
基态铜原子的电子排布式为 ______ ;从铜原子价层电子结构变化角度来看,高温时CuO与![]() 的稳定性是CuO ______
的稳定性是CuO ______ ![]() 填写“
填写“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ______ ,若“
硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ______ ,若“![]() ”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se ______
”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se ______ ![]() 填“
填“![]() ”、“
”、“![]() ”
”![]() 。
。
![]() 常温下白色晶体,熔点为
常温下白色晶体,熔点为![]() ,
,![]() 时升华,则
时升华,则![]() 固体的晶体类型为 ______ ;
固体的晶体类型为 ______ ;![]() 分子中Se原子的杂化类型为 ______ 。
分子中Se原子的杂化类型为 ______ 。
![]() 镓元素在元素周期表中的位置是 ______ ,该族元素都具有缺电子性
镓元素在元素周期表中的位置是 ______ ,该族元素都具有缺电子性![]() 价电子数少于价层轨道数
价电子数少于价层轨道数![]() ,其化合物可与具有孤对电子的分子或离子生成配合物,如
,其化合物可与具有孤对电子的分子或离子生成配合物,如![]() 能与
能与![]() 反应生成BF3·NH3,BF3·NH3的结构简式可表示为 ______ 。
反应生成BF3·NH3,BF3·NH3的结构简式可表示为 ______ 。
![]() 金刚砂
金刚砂![]() 的晶胞结构如图所示:
的晶胞结构如图所示:
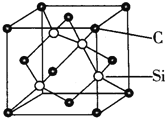
则在SiC中,每个C原子周围紧邻的C原子数目为 ______ 个;若晶胞的边长为apm,则金刚砂的密度为 ______ ![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL0.2mol·L-1的Na2SO4溶液。回答下列问题:
(1)填写下列实验操作步骤中的空白处:
A.在天平上称取___gNa2SO4固体,把它放在___中,用适量的蒸馏水溶解;
B.把制得的溶液小心地沿着___注入___中;
C.继续向容量瓶中加入蒸馏水至液面离容量瓶颈刻度线下1~2cm时,改用___小心滴加蒸馏水至溶液凹液面最低处与刻度线水平相切;
D.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中,并轻轻摇匀;
E.盖好瓶塞,反复上下颠倒,摇匀。
(2)第(1)题中操作步骤的正确顺序是(填标号)___。
(3)下列情况中,会使所配溶液浓度偏高的是___(填标号)。
a.溶解搅拌时有部分液体溅出
b.加蒸馏水时,不慎超过了刻度线
C.在定容时,俯视刻度线
d.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol重水(D2O)分子中含有的中子数为NA
B.10g质量分数为46%的C2H5OH水溶液中含有的氧原子数目为0.1NA
C.标准状况下,2.24L已烷中含有的共价键数目为1.9NA
D.过氧化氢分解制得标准状况下2.24LO2,转移电子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是
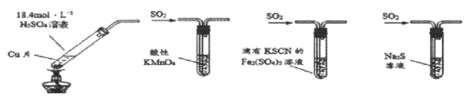
A.若将甲中上层清液倒入水中,观察到溶液呈蓝色,说明有CuSO4生成
B.图乙装置中溶液的颜色变浅,说明SO2具有漂白性
C.图丙装置中溶液的颜色变浅,说明SO2具有还原性
D.图丁装置中产生淡黄色沉淀,说明SO2或H2SO3具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X和Y的核电荷数都小于18,最外层电子数分别为n和(m-5),次外层分别有(n+2)个和m个电子。甲和乙分别为元素X、Y的最高价氧化物的水化物。
(1)元素名称X为____________________,Y为____________________。
(2)甲的化学式是____________________,乙的化学式是____________________。
(3)甲与乙反应的离子方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气中含有SO2,易形成酸雨、污染大气。有效去除和利用SO2是环境保护的重要议题。
(1)双碱法洗除SO2。NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
①上述过程生成Na2SO3的离子方程式为_________。
②双碱法洗除SO2的优点为_________。
(2)NaClO2氧化法吸收SO2。向NaClO2溶液中通入含有SO2的烟气,反应温度为323 K,反应一段时间。
①随着吸收反应的进行,吸收剂溶液的pH逐渐_________(填“增大”“不变”或“减小”)。
②如果采用NaClO替代NaClO2,也能得到较好的烟气脱硫效果。吸收等量的SO2,所需NaClO的物质的量是NaClO2的_________倍。
(3)SO2的利用。生产焦亚硫酸钠(Na2S2O5),通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺如下:
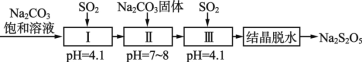
①Ⅰ中反应的化学方程式为___________。
②若Ⅲ中通入SO2不足,结晶脱水得到的Na2S2O5中混有的主要杂质是_______(填化学式)。
③工艺中加入Na2CO3固体,并再次充入SO2的目的是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com