
【题目】Ag2O2是银锌碱性电池的正极活性物质,用如下方法制备:在过量KOH溶液中加入适量AgNO3溶液,生成Ag2O沉淀;保持反应温度为80℃,再边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中。反应完全后,过滤、洗涤、真空干燥就可得到固体样品。整个制备过程可用下列化学反应方程式描述:2AgNO3+4KOH+K2S2O8 ![]() Ag2O2↓+2KNO3 +2K2SO4+2H2O。在上述制备过程中,沉淀表面吸附物质不含有( )
Ag2O2↓+2KNO3 +2K2SO4+2H2O。在上述制备过程中,沉淀表面吸附物质不含有( )
A. KNO3B. K2SO4C. KOHD. AgNO3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物![]() 浓度均为
浓度均为![]() 溶液的pH和原子序数的关系如图所示。
溶液的pH和原子序数的关系如图所示。

![]() 元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
![]() 元素Y和W形成的
元素Y和W形成的![]() 型化合物中含有化学键的类型为______。
型化合物中含有化学键的类型为______。
![]() 短周期元素C、O、S能形成多种化合物,如
短周期元素C、O、S能形成多种化合物,如![]() 、
、![]() 、COS等。
、COS等。
![]() 下列能说明碳、硫两种元素非金属性相对强弱的是______
下列能说明碳、硫两种元素非金属性相对强弱的是______![]() 填序号
填序号![]()
A.S与![]() 发生化合反应比C与
发生化合反应比C与![]() 化合更容易
化合更容易
B.酸性:![]()
C.![]() 中碳元素为
中碳元素为![]() 价,硫元素为
价,硫元素为![]() 价
价
![]() 铅
铅![]() 、锡
、锡![]() 、锗
、锗![]() 与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
![]() 锗的原子序数为______。
锗的原子序数为______。
![]() 它们
它们![]() 价氢氧化物的碱性由强到弱顺序为______
价氢氧化物的碱性由强到弱顺序为______![]() 填化学式
填化学式![]() 。
。
![]() 羰基硫
羰基硫![]() 可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和
可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和![]() 相似。
相似。
![]() 用电子式表示羰基硫
用电子式表示羰基硫![]() 的形成过程:______。
的形成过程:______。
![]() 羰基硫
羰基硫![]() 用氢氧化钠溶液处理及利用的过程如图:
用氢氧化钠溶液处理及利用的过程如图:

已知A是一种正盐,则A的化学式为______;若气体a为单质,反应II的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末X中可能含有K2SO4、(NH4)2CO3、NaNO3 、K2SO3、Cu2O、FeO、Fe2O3中几种。为确定其组成,某同学进行如下实验:
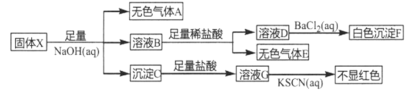
已知: Cu2O+2H+= Cu2++Cu+ H2O
根据实验过程及现象,下列说法正确的是
A.无色气体A可用湿润的蓝色石蕊试纸检验
B.固体X中一定含有(NH4)2CO3、K2SO3、FeO
C.无色气体E一定含有CO2,一定不含SO2.
D.固体X中可能含有Cu2O、Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X和Y的核电荷数都小于18,最外层电子数分别为n和(m-5),次外层分别有(n+2)个和m个电子。甲和乙分别为元素X、Y的最高价氧化物的水化物。
(1)元素名称X为____________________,Y为____________________。
(2)甲的化学式是____________________,乙的化学式是____________________。
(3)甲与乙反应的离子方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-= AlO2-+H2↑
B.过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将1.92gCu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL的NOX混合气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入标准状况下的O2的体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为___。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中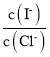 为:___,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:___,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g) ΔH=+11kJ·mol-1,
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为___。若起始时n(HI)=100mol,则过程中需吸收的能量为___kJ。
②上述反应中,正反应速率为v正=k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为___(以K和k正表示)。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为___(填字母)
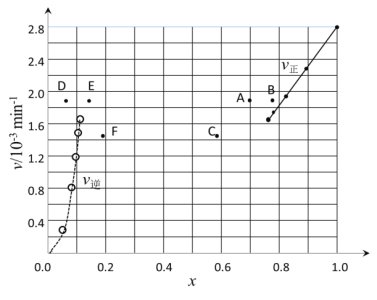
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol ·L-1 | 0.10 | 0.20 | 0.20 |
c(SO2)/mol ·L-1 | 0.10 | 0.10 | 0.20 |
A.平衡时,乙中SO2的转化率大于50%
B.当反应平衡时,丙中c(SO2)是甲中的2倍
C.温度升至90℃,上述反应平衡常数为25/16,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol ·L-1 NO2和0.20 mol ·L-1 SO2,达到平衡时c(NO)与原平衡不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com