
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
![]()
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
【答案】C
【解析】试题分析:转化后所得溶液中铬元素含量为28.6g/L,则1L废水中n(Cr)= ![]() =0.55mol。A、存在平衡:2Cr O42-(黄色)+2H+
=0.55mol。A、存在平衡:2Cr O42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,如颜色不变,说明浓度不变,则达到平衡状态,故A正确;B、若用绿矾(FeSO47H2O)(M=278)作还原剂,处理1L废水,设需要xmolFeSO47H2O,由氧化还原反应中氧化剂和还原剂得失电子数目相等可知0.55×(6-3)=x×(3-2),x=1.65,m(FeSO47H2O)=1.65mol×278g/mol=458.7g,故B正确;C、1L废水中n(Cr)=
Cr2O72-(橙色)+H2O,如颜色不变,说明浓度不变,则达到平衡状态,故A正确;B、若用绿矾(FeSO47H2O)(M=278)作还原剂,处理1L废水,设需要xmolFeSO47H2O,由氧化还原反应中氧化剂和还原剂得失电子数目相等可知0.55×(6-3)=x×(3-2),x=1.65,m(FeSO47H2O)=1.65mol×278g/mol=458.7g,故B正确;C、1L废水中n(Cr)= ![]() =0.55mol,CrO42-有
=0.55mol,CrO42-有![]() 转化为Cr2O72-,则酸化后c(CrO42-)=0.55mol/L×(1-
转化为Cr2O72-,则酸化后c(CrO42-)=0.55mol/L×(1-![]() )=0.05mol/L,c(Cr2O72-)=0.55mol/L×
)=0.05mol/L,c(Cr2O72-)=0.55mol/L×![]() ×
×![]() =0.25mol/L,常温下转换反应的平衡常数K=1×1014,则
=0.25mol/L,常温下转换反应的平衡常数K=1×1014,则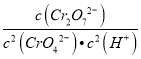 =1×1014,c(H+)=1×10-6mol/L,所以pH=6,故C错误;D、常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,则c(Cr3+)×c3(OH-)=1×10-32,c(OH-)=1×10-9mol/L,pH=5,故D正确;故选C。
=1×1014,c(H+)=1×10-6mol/L,所以pH=6,故C错误;D、常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,则c(Cr3+)×c3(OH-)=1×10-32,c(OH-)=1×10-9mol/L,pH=5,故D正确;故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合成氨工业对国民经济和社会发展具有重要意义,对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0。写出该反应化学平衡常数表达式_______,升高温度,该反应化学反应速率_______,氢气的转化率_______ (以上均填“增大”、“减小”或“不变”)。实际生产中温度一般控制在500℃,原因是_______。
2NH3(g) ΔH<0。写出该反应化学平衡常数表达式_______,升高温度,该反应化学反应速率_______,氢气的转化率_______ (以上均填“增大”、“减小”或“不变”)。实际生产中温度一般控制在500℃,原因是_______。
(2)在500℃下合成甲醇的反应原理为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1molCO2和3molH2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1molCO2和3molH2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
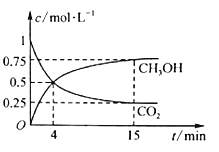
①反应进行到4 min时,v(正)________ (填“>”“<”或“=”)v(逆)。0~4 min,H2的平均反应速率v(H2)= _______。
②下列能说明该反应已达到平衡状态的是_______。
A v正(CH3OH)=3v逆(H2) B CO2、H2、CH3OH和H2O浓度之比为1:3:1:1
C 恒温恒压下,气体的体积不再变化 D 恒温恒容下,气体的密度不再变化
③500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
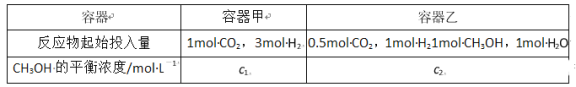
则乙容器中反应起始向_______方向进行;c1_______c2(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是药物生产的中间体,其结构简式如图。下列有关叙述不正确的是( )
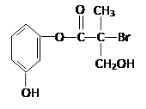
A.该有机物与浓溴水可发生取代反应
B.1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH
C.该有机物与浓硫酸混合共热可发生消去反应
D.该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性ZnO在橡胶、塑料、涂料工业有重要应用,工业上用含锌物料(含FeO、CuO等杂质)制取活性ZnO的流程如图所示:
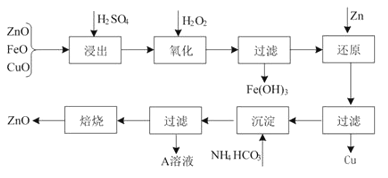
(1)上述流程中,浸出时用的是60% H2SO4(密度是1.5 g/cm3),则该H2SO4的物质的量浓度为______________ (保留两位小数) 。
(2)上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04 mol·L-1,控制滤液的pH,加入H2O2后产生大量红褐色沉淀。
①粗略测定溶液pH的实验操作是___________________________________________。
②已知:常温下Fe(OH)3的Ksp=4.0×10-38。滤液的pH至少为________时,溶液中Fe3+开始沉淀。
(3)A溶液中主要含有的溶质是______________,验证溶质所含阳离子的方法是_____________。
(4)制备ZnO所焙烧的物质是含结晶水的碱式碳酸锌。取碱式碳酸锌6.82g,溶于HCl生成CO2 448 mL(标准状况下),溶解过程消耗HCl 0.12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机物的结构表示为![]() ,其名称是________________________。
,其名称是________________________。
(2)写出下列反应的化学方程式:
①草酸能使酸性高锰酸钾溶液褪色:____________________________________。
②把浓硝酸、浓硫酸和甲苯混合加热制备TNT:______________________________。
③溴乙烷在一定条件下发生消去反应:__________________________________。
(3)某烃A分子中碳的质量分数为90.57%,在某温度下V L该烃的蒸气质量是相同状况下V L H2质量的53倍,则烃A的分子式为______________;若烃A分子中含有苯环,且苯环上的一氯代物只有一种,则A的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将Ⅰ阀关闭,Ⅱ阀打开,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③NaOH溶液 ④饱和碳酸钠溶液 ⑤水

A. ①③ B. ②⑤ C. ②③⑤ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系中不正确的是
A.c=1 000Vρ/(17V+22 400)B.w=17c/(1000ρ)
C.w=17V/(17V+22 400)D.ρ=(17V+22 400)/(22.4+22.4V)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g) △H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A. 容器I、Ⅲ中平衡常数相同
B. 容器II、Ⅲ中正反应速率相同
C. SO3的体积分数:Ⅱ>III
D. 容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和大于1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com