
【题目】(1)合成氨工业对国民经济和社会发展具有重要意义,对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0。写出该反应化学平衡常数表达式_______,升高温度,该反应化学反应速率_______,氢气的转化率_______ (以上均填“增大”、“减小”或“不变”)。实际生产中温度一般控制在500℃,原因是_______。
2NH3(g) ΔH<0。写出该反应化学平衡常数表达式_______,升高温度,该反应化学反应速率_______,氢气的转化率_______ (以上均填“增大”、“减小”或“不变”)。实际生产中温度一般控制在500℃,原因是_______。
(2)在500℃下合成甲醇的反应原理为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1molCO2和3molH2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1molCO2和3molH2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
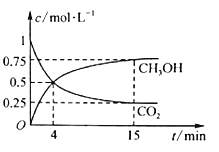
①反应进行到4 min时,v(正)________ (填“>”“<”或“=”)v(逆)。0~4 min,H2的平均反应速率v(H2)= _______。
②下列能说明该反应已达到平衡状态的是_______。
A v正(CH3OH)=3v逆(H2) B CO2、H2、CH3OH和H2O浓度之比为1:3:1:1
C 恒温恒压下,气体的体积不再变化 D 恒温恒容下,气体的密度不再变化
③500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
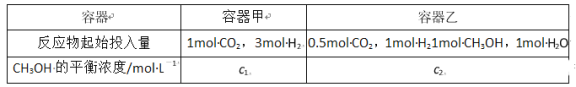
则乙容器中反应起始向_______方向进行;c1_______c2(填“>”“<”或“=”)。
【答案】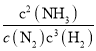 增大 减小 此温度下催化剂的活性较高 > 0.375 C 逆反应 <
增大 减小 此温度下催化剂的活性较高 > 0.375 C 逆反应 <
【解析】
(1)该反应的平衡常数为K=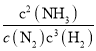 ,升高温度,化学反应速率加快,由于反应放热,升高温度,氢气转化率减小,实际生产中温度一般控制在500℃,原因是此温度下催化剂的活性较高;
,升高温度,化学反应速率加快,由于反应放热,升高温度,氢气转化率减小,实际生产中温度一般控制在500℃,原因是此温度下催化剂的活性较高;
(2)①反应进行到4min时,反应尚未达到平衡状态,v(正)>v(逆),0~4 min,CO的浓度减少了0.5mo/L,则氢气的浓度减少了1.5mol/L,H2的平均反应速率v(H2)=1.5mol/L÷4min=0.375mol·L-1·min-1;
②A. v正(CH3OH)=3v逆(H2)说明正逆反应速率不相等,故不能说明反应已达平衡;
B. CO2、H2、CH3OH和H2O浓度之比为1:3:1:1,与投料有关,不能说明反应已达平衡;
C.恒温恒压下,气体的体积不再变化,说明反应已达平衡;
D.恒温恒容下,气体的密度不是一个变量,当其不再变化,不能说明反应达到平衡;
故答案选C;
③容器乙![]() ,可根据曲线图算出反应的平衡常数
,可根据曲线图算出反应的平衡常数![]() ,Qc>K,平衡逆向进行。将容器甲的投料归到右边相当于是1mol甲醇和1mol水蒸气,所以最终平衡时c1<c2。
,Qc>K,平衡逆向进行。将容器甲的投料归到右边相当于是1mol甲醇和1mol水蒸气,所以最终平衡时c1<c2。


科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
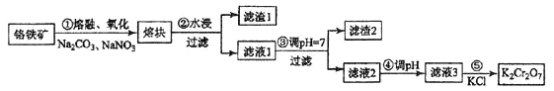
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氢氧化钡固体②KHSO4③HNO3④稀硫酸⑤二氧化碳气体⑥铜⑦碳酸钠粉末⑧蔗糖晶体⑨熔融氯化钠⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是___。
(2)属于电解质的是____。
(3)属于非电解质的是___。
(4)②在水溶液中的电离方程式为___,①与②在溶液中反应使溶液呈中性的离子方程式为____。
(5)③与⑥可以发生如下反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
I.还原产物是___。
II.用单线桥法标出反应中电子转移的方向和数目___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中。在此过程中溶液的pH与Cl2用量的关系示意图是(溶液体积变化忽略不计,且不考虑Cl2与水反应)
A. 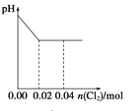 B.
B. 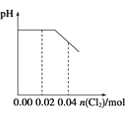 C.
C.  D.
D. 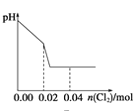
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断下列结论错误的是( )
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断下列结论错误的是( )
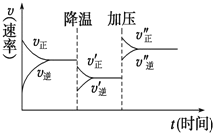
A.正反应是放热反应B.A、B一定都是气体
C.D一定不是气体D.C可能是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4 溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 2.0 | 1.0 | 6.4 |

(1)根据上表中的实验数据,可以得到的结论是_______。
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是_______。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体X | 室温下溶液颜 色褪至无色所需时间/min | |||
0.6mol/LH2C2O4 溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
固体X是_______。
③若该小组同学提出的假设成立,时间t_______4.0min(填>、=或<)。
(3)为探究温度对化学反应速率的影响,该小组同学准备在上述实验基础上继续进行实验,请你帮助该小组同学完成该实验方案设计_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料.
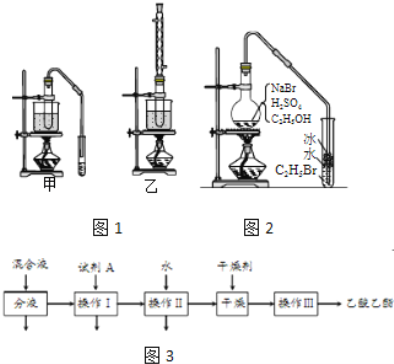
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______.
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是______(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______.(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置如图1都可以选用.关于这两套装置的说法正确的是______.(选填编号)
物质 | 沸点(℃) |
乙醇 | 78.5 |
乙酸 | 117.9 |
乙酸乙酯 | 77 |
a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3,以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物.
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇.
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色.与方案①相比较,方案②的明显缺点是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
![]()
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)具有多晶陶瓷在材料制备方面的优势,有着广阔的应用前景。工业上利用某铝土矿(含Al2O3及少量的MgO等杂质)生产氮氧化铝的流程如图所示。回答下列问题:
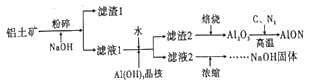
(1)为提高铝土矿碱浸的速率,除粉碎外,还可以采取的措施是_____(写出一项即可)
(2)滤液1的溶质有NaOH、_____。滤渣2的成分是_____。向滤液1中加水的目的是_______。该过程也可用通入足量的_____气体的方法来代替。
(3)滤液2浓缩的过程中常会吸收空气中的CO2,为得到纯净的NaOH,需要加入适量____(填化学式)。整个流程中,可循环的物质是_____。
(4)写出制备AlON的化学方程式_______。
(5)取1吨Al2O3质量分数为91.8%的铝土矿样品,利用上述流程AlON,最终制得氮氧化铝820.8kg,则氮氧化铝的产率为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com