
【题目】一定条件下存在反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g) △H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A. 容器I、Ⅲ中平衡常数相同
B. 容器II、Ⅲ中正反应速率相同
C. SO3的体积分数:Ⅱ>III
D. 容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和大于1
【答案】C
【解析】
A.容器Ⅰ是绝热容器,反应过程中温度升高,平衡逆向进行,平衡常数减小,容器Ⅰ、Ⅲ中平衡常数不相同,A错误;
B.容器Ⅲ是恒压容器,反应过程中压强大于容器Ⅰ,反应速率大,容器Ⅱ、Ⅲ中正反应速率不相同,B错误;
C.容器Ⅱ是恒温恒容,Ⅲ是恒温恒压,随着反应的进行,容器Ⅱ中压强大于容器Ⅲ,平衡正向进行,三氧化硫含量增大,SO3的体积分数:Ⅱ>Ⅲ,C正确;
D.若容器Ⅱ恒温恒容,容器Ⅰ也是恒温恒容时,达到相同平衡状态,二氧化硫转化率和三氧化硫转化率之和为1,但实际容器Ⅰ是绝热恒容,随反应进行温度升高,平衡逆向进行,二氧化硫转化率减小,因此容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1,D错误;
故合理选项是C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
![]()
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)具有多晶陶瓷在材料制备方面的优势,有着广阔的应用前景。工业上利用某铝土矿(含Al2O3及少量的MgO等杂质)生产氮氧化铝的流程如图所示。回答下列问题:
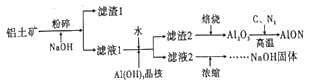
(1)为提高铝土矿碱浸的速率,除粉碎外,还可以采取的措施是_____(写出一项即可)
(2)滤液1的溶质有NaOH、_____。滤渣2的成分是_____。向滤液1中加水的目的是_______。该过程也可用通入足量的_____气体的方法来代替。
(3)滤液2浓缩的过程中常会吸收空气中的CO2,为得到纯净的NaOH,需要加入适量____(填化学式)。整个流程中,可循环的物质是_____。
(4)写出制备AlON的化学方程式_______。
(5)取1吨Al2O3质量分数为91.8%的铝土矿样品,利用上述流程AlON,最终制得氮氧化铝820.8kg,则氮氧化铝的产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 溶液在空气中缓慢变质为
溶液在空气中缓慢变质为![]() 中的一种或几种。已知:
中的一种或几种。已知:![]() ,
,![]() 是一种具有臭鸡蛋气味的气体。关于
是一种具有臭鸡蛋气味的气体。关于![]() 溶液变质情况的探究,下列说法不正确的是
溶液变质情况的探究,下列说法不正确的是
A. 向样品中加入足量稀盐酸,不变浑浊,再滴加![]() 溶液,产生白色沉淀,则样品中一定含有
溶液,产生白色沉淀,则样品中一定含有![]()
B. 向样品中加入足量稀盐酸,产生臭鸡蛋气味的气体,溶液变浑浊,则样品中至少含有![]() 、
、![]() ,中的一种
,中的一种
C. 向样品中加入足量稀盐酸,加热,产生使品红溶液褪色的气体,溶液变浑浊,则样品中至少含有![]() 中的一种
中的一种
D. 向样品中加入足量稀盐酸,加热,将产生的气体依次通过酸性高锰酸钾溶液、澄清石灰水,前者未完全褪色,后者变浑浊,则样品中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列化工生产流程的说法不正确的是
①铁矿石、焦炭、石灰石、空气、生铁
②黄铜矿![]() Cu2S
Cu2S![]() Cu(粗)
Cu(粗)![]() Cu(精)
Cu(精)
③石英![]() Si(粗)
Si(粗)![]() SiCl4
SiCl4![]() Si(高纯)
Si(高纯)
④![]()
A. ①的主要设备是炼铁高炉,生产过程中产生的高炉煤气主要成分是![]() 等,形成的炉渣中某成分可用作生产普通玻璃
等,形成的炉渣中某成分可用作生产普通玻璃
B. ②中电解精炼铜时,粗铜中的杂质全部沉积在阳极区,由![]() 组成的电解液需循环更换
组成的电解液需循环更换
C. ③中粗硅与![]() 反应后,可用分馏的方法提纯
反应后,可用分馏的方法提纯![]()
D. ④中Ⅰ、IV两步转化后的气体均需循环以提高原料的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物X是由两种短周期元素和一种长周期元素组成的盐,可溶于水,与酸反应只生成两种盐和水,某学习小组进行了如下实验:
①取![]() ,加入
,加入![]() 的盐酸,无气体产生,得澄清溶液,将其两等分;
的盐酸,无气体产生,得澄清溶液,将其两等分;
②向其中一份溶液中加入过量的![]() 溶液,过滤,得到溶液A和
溶液,过滤,得到溶液A和![]() 白色沉淀B,B是医疗上的胃肠造影剂;
白色沉淀B,B是医疗上的胃肠造影剂;
③向另一份溶液中逐滴加入![]() 的
的![]() 溶液,当
溶液,当![]() 时恰好中和,继续滴加生成白色沉淀,当
时恰好中和,继续滴加生成白色沉淀,当![]() 时,沉淀恰好溶解完全。
时,沉淀恰好溶解完全。
请回答:
(1)化合物X中三种元素对应的简单离子,半径最小的离子结构示意图为___________。
(2)化合物X的化学式为_______________。
(3)将化合物X完全溶于水后,溶液呈强碱性,通入足量![]() ,生成白色沉淀,写出通入足量
,生成白色沉淀,写出通入足量![]() 所发生反应的离子方程式:__________________。
所发生反应的离子方程式:__________________。
(4)设计实验检验溶液A中的阴离子(不考虑水的电离):_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,当溶液中离子浓度小于1×10-5mol·L-1时,可认为该离子沉淀完全。下列叙述正确的是( )
A. 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
B. 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
C. 向0.000 8 mol·L-1的K2CrO4溶液中加入等体积的0.002 mol·L-1AgNO3溶液,则CrO42-完全沉淀
D. 将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等体积的一氧化二氮(N2O)和二氧化碳两种气体相比较:①质量相等、②所含碳原子数与氮原子数相等、③所含分子数相等。上述结论中正确的是( )
A. ①②③ B. ②③ C. ①② D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以丁烯二醛和肼为原料经过DielsAlder反应合成哒嗪,合成关系如图:
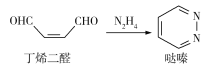
下列说法正确的是
A. 哒嗪与氢气加成后的产物分子式为C4H6N2
B. 聚丁烯二醛因无碳碳双键不能使溴水褪色
C. 丁烯二醛与N2H4可以在一定条件下加成后再消去可制得哒嗪
D. 物质的量相等的丁烯二醛和哒嗪分别与氢气完全加成,消耗氢气的量不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com