
����Ŀ����֪������X�������ֶ�����Ԫ�غ�һ�ֳ�����Ԫ����ɵ��Σ�������ˮ�����ᷴӦֻ���������κ�ˮ��ijѧϰС�����������ʵ�飺
��ȡ![]() ������
������![]() �����ᣬ������������ó�����Һ���������ȷ֣�
�����ᣬ������������ó�����Һ���������ȷ֣�
��������һ����Һ�м��������![]() ��Һ�����ˣ��õ���ҺA��
��Һ�����ˣ��õ���ҺA��![]() ��ɫ����B��B��ҽ���ϵ�θ����Ӱ����
��ɫ����B��B��ҽ���ϵ�θ����Ӱ����
������һ����Һ����μ���![]() ��
��![]() ��Һ����
��Һ����![]() ʱǡ���кͣ������μ����ɰ�ɫ��������
ʱǡ���кͣ������μ����ɰ�ɫ��������![]() ʱ������ǡ���ܽ���ȫ��
ʱ������ǡ���ܽ���ȫ��
��ش�
��1��������X������Ԫ�ض�Ӧ�ļ����ӣ��뾶��С�����ӽṹʾ��ͼΪ___________��
��2��������X�Ļ�ѧʽΪ_______________��
��3����������X��ȫ����ˮ����Һ��ǿ���ԣ�ͨ������![]() �����ɰ�ɫ������д��ͨ������
�����ɰ�ɫ������д��ͨ������![]() ��������Ӧ�����ӷ���ʽ��__________________��
��������Ӧ�����ӷ���ʽ��__________________��
��4�����ʵ�������ҺA�е������ӣ�������ˮ�ĵ��룩��_______________________________��
���𰸡�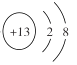
![]() ���
��д��![]() Ҳ�ɣ�
Ҳ�ɣ� ![]() ȡ������ҺA���Թ��У�����ϡ��������ᱵ��Һ�����ɰ�ɫ������˵����
ȡ������ҺA���Թ��У�����ϡ��������ᱵ��Һ�����ɰ�ɫ������˵����![]() �����ˣ�����Һ�еμ���������Һ�����ɰ�ɫ������˵����
�����ˣ�����Һ�еμ���������Һ�����ɰ�ɫ������˵����![]()
��������
����BΪ![]() ��X�к�BaԪ�أ����ʵ���Ϊ
��X�к�BaԪ�أ����ʵ���Ϊ![]() =0.06mol������
=0.06mol������![]() ��Һ�����ɰ�ɫ���������ܽ���ȫ��X�к�AlԪ�أ�����
��Һ�����ɰ�ɫ���������ܽ���ȫ��X�к�AlԪ�أ�����![]() ���X�к�Alԭ�ӵ����ʵ���Ϊ
���X�к�Alԭ�ӵ����ʵ���Ϊ![]() ���ɻ�����X���ᷴӦֻ���������κ�ˮ����ȷ��������Ԫ��ΪO�������ʵ���Ϊ
���ɻ�����X���ᷴӦֻ���������κ�ˮ����ȷ��������Ԫ��ΪO�������ʵ���Ϊ![]() �����ϣ�������X��
�����ϣ�������X��![]() ������Ϊ
������Ϊ![]() �������Σ����Ϊ����������Ҳ��д����������ʽ���ݴ˷�������
�������Σ����Ϊ����������Ҳ��д����������ʽ���ݴ˷�������
��1�����ӵĵ��Ӳ���Խ�࣬�뾶Խ���Ӳ�����ͬʱ���˵����ԽС���Ӱ뾶Խ����![]() �������ӣ��뾶��С��Ϊ
�������ӣ��뾶��С��Ϊ![]() �������ӽṹʾ��ͼΪ
�������ӽṹʾ��ͼΪ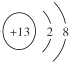 ��
��
��2����������������֪��������X��![]() ������Ϊ
������Ϊ![]() ������X�Ļ�ѧʽΪ
������X�Ļ�ѧʽΪ![]() ��д��
��д��![]() Ҳ�ɣ���
Ҳ�ɣ���
��3��![]() ��ͨ������
��ͨ������![]() ���ɰ�ɫ����Ϊ
���ɰ�ɫ����Ϊ![]() �����ӷ���ʽΪ
�����ӷ���ʽΪ![]() ��
��
��4����ҺA��ͬʱ����![]() ��
��![]() ����˿�ȡ������ҺA���Թ��У�����ϡ��������ᱵ��Һ�����ɰ�ɫ������˵����
����˿�ȡ������ҺA���Թ��У�����ϡ��������ᱵ��Һ�����ɰ�ɫ������˵����![]() �����ˣ�����Һ�еμ���������Һ�����ɰ�ɫ������˵����
�����ˣ�����Һ�еμ���������Һ�����ɰ�ɫ������˵����![]() ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ij�л���Ľṹ��ʾΪ![]() ����������________________________��
����������________________________��
(2)д�����з�Ӧ�Ļ�ѧ����ʽ��
�ٲ�����ʹ���Ը��������Һ��ɫ��____________________________________��
�ڰ�Ũ���ᡢŨ����ͼױ���ϼ����Ʊ�TNT��______________________________��
����������һ�������·�����ȥ��Ӧ��__________________________________��
(3)ij��A������̼����������Ϊ90.57%����ij�¶���V L������������������ͬ״����V L H2������53��������A�ķ���ʽΪ______________������A�����к��б������ұ����ϵ�һ�ȴ���ֻ��һ�֣���A�Ľṹ��ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ����������ʹ�õĽ���֮һ�����γɶ��ֻ�������γ���λ������ش��������⣺
��1��Cuλ�����ڱ��������ڵ�___�塣д�����̬ԭ�ӵĵ����Ų�ʽ_____��
��2��Ԫ��Ni��Cu������
��Ni��Cu��ȣ���̬ԭ����δ�ɶԵ���___.(�����������������������)��
�ڵڶ�������Cu��Ni�ߣ�ԭ����_____��
��3��Cu���Ժ�EDA( )�γ���������̼ԭ�ӵ��ӻ���ʽ��____������C��N��O�ĵ縺���ɴ�С��˳����_____��
)�γ���������̼ԭ�ӵ��ӻ���ʽ��____������C��N��O�ĵ縺���ɴ�С��˳����_____��
��4��CuSO4���ȷֽ�ķ���ʽΪ2CuSO4===Cu2O+SO2��+SO3��+O2����
��SO2�Ŀռ乹��Ϊ_____��O2������![]() ���ĸ�������______��
���ĸ�������______��
��������ͭ�ľ�������ͼ��ʾ������Aԭ��������(0��0��0)��Cԭ��������(![]() ��
��![]() ��
��![]() )����Bԭ��������____���������Cu+��O2-�ĺ˾���anm����NA��ʾ�����ӵ�������ֵ����������ͭ���ܶ���_____g��cm��3
)����Bԭ��������____���������Cu+��O2-�ĺ˾���anm����NA��ʾ�����ӵ�������ֵ����������ͭ���ܶ���_____g��cm��3

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������10 mL 0.1 mol��L��1 NaOH��Һ�м���0.1 mol��L��1��һԪ
��HA����ҺpH�ı仯������ͼ��ʾ������˵����ȷ����

A. a����ʾ��Һ��c(Na��)��c(A��)��c(H��)��c(HA)
B. a��b������ʾ��Һ��ˮ�ĵ���̶���ͬ
C. pH��7ʱ��c(Na��)��c(A��)��c(HA)
D. b����ʾ��Һ��c(A��)��c(HA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������´��ڷ�Ӧ��2SO2(g)+O2(g)![]() 2SO3(g) ��H��0���������������ͬ���ܱ�����������ͼ��ʾͶ�ϣ�����400�������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����
2SO3(g) ��H��0���������������ͬ���ܱ�����������ͼ��ʾͶ�ϣ�����400�������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����

A. ����I������ƽ�ⳣ����ͬ
B. ����II����������Ӧ������ͬ
C. SO3�������������III
D. ��������SO2��ת��������������SO3��ת����֮�ʹ���1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ�ζ�ʵ��������к͵ζ����ƣ�����֪Ũ�ȵ���������Һ�ζ�δ֪Ũ�ȵĻ�ԭ����Һ��֮������Ѫ�Ƶĺ���ʱ����������ʵ�飺
�ٿɽ�2mLѪҺ������ˮϡ�ͺ������м�����������泥�NH4��2C2O4���壬��Ӧ���� CaC2O4��������������ϡ���ᴦ����H2C2O4��Һ��
�ڽ��ٵõ���H2C2O4��Һ����������KMnO4��Һ�ζ�����������ΪCO2����ԭ����ΪMn2+��
���յ�ʱ��ȥ20mL l.0��l0��4 mol/L��KMnO4��Һ��
��1��д����KMn04�ζ�H2C2O4�����ӷ���ʽ_____________________��
��2���ζ�ʱ����KMnO4��Һװ��________�����ʽ����ʽ�����ζ����С�
��3���жϵζ��յ�ķ�����________________________��
��4�������������ƫ�ߡ�����ƫ�͡�����Ӱ�족��
������ζ���������ˮϴ��δ������KMnO4��Һ��ϴ����������________��
�ڵζ�ǰ���������ȷ�����ζ�ǰ�����ݣ����ζ���������ʧ����������________��
��5�����㣺ѪҺ�к������ӵ�Ũ��Ϊ________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӵ�ʳ���к��е����(KIO3)�����Ե�ⷨ�Ʊ�����أ�ʵ��װ����ͼ��ʾ���Ƚ�һ�����ĵ����ڹ�������������Һ��������Ӧ��3I2��6KOH===5KI��KIO3��3H2O��������Һ��������������������������Һ��������������ʼ��⡣����˵������ȷ����(����)

A. ��������OH����a����ͨ�����ӽ���Ĥc����b����
B. ���ŵ����У�KOH��ҺŨ�Ȼ���С
C. a�缫��Ӧʽ��I����6e����6OH��=== IO![]() ��3H2O��a������KI����ת��ΪKIO3
��3H2O��a������KI����ת��ΪKIO3
D. ��������0.1 mol I���ŵ�ʱ����������6.72 L H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CO��CO2�Ļ������20�ˣ����ڱ�״���µ����Ϊ11.2L���ݴ˻ش��������⣺
��1���û�������ܵ����ʵ���Ϊ______����ƽ��Ħ������Ϊ_______��
��2�����������̼ԭ�ӵĸ���Ϊ________������NA��ʾ�����ӵ�������ֵ��
��3�������û������ȫ��ͨ����ͼװ�ý���ʵ�顣

���������ռ���������______��������Ϊ_______ ��
����Aƿ�л�ó��������IJ�����_____��������
����Ҫ֤��Aƿ��Һ�е��������Ƿ������ȫ���䷽��Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ֻ������Ǻܶ����Ϳ�����Ҫ�ɷ֣���ṹ��ͼ��ʾ������W��X��Y��ZΪԭ��������������Ķ���������Ԫ�أ�ֻ��X��Y��ͬһ���ڣ�Y��������ۣ�Z�ĺ���������������ԣ������й�˵����ȷ����
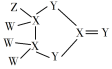
A. WZ�е����W2Y�ķе�
B. ��Z�������ᷴӦ���Ƶ�Z�ĵ���
C. W2Y2���ɼ��Լ��ͷǼ��Լ����ɵķǼ��Է���
D. X�ĺ�����һ��Ϊ��Ԫ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com