
| A、c(OH-)/c(NH3?H2O) |
| B、c(NH3?H2O)/c(OH-) |
| C、c(H+)和c(OH-)的乘积 |
| D、c(H+) |


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
| A、氯气溶于水:Cl2+H2O?H++Cl-+HClO | ||||
B、MnO2 与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| C、Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | ||||
| D、向NaHCO3溶液中加过量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液的装置.用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀.下列说法正确的是( )
如图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液的装置.用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀.下列说法正确的是( )| A、A处通入的气体为O2,B处通入的气体为CH4 |
| B、电池内部K+向b极移动,OH-向a极移动 |
| C、图1装置中发生的总反应为CH4+2O2═CO2+2H2O |
| D、图1、图2中电解质溶液的pH均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、(
| ||||
| B、( 2b-a ) mol/L | ||||
C、( 5b-
| ||||
| D、( l0b-5a )mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
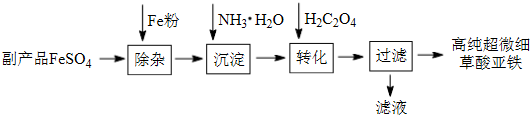
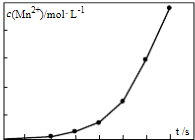
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com