
L��M��R��P��Q�ֱ�������ֺ���ͬ���ϼ۵ĵ�Ԫ�ص����ʡ�A��B�ֱ�������ֺ���ͬ���ϼ۵���Ԫ�ص�����(ÿ�������е�����Ԫ�صĻ��ϼ�ֻ��һ��)����֪����M�еĵ�Ԫ�ػ��ϼ�Ҫ������Q�е�Ԫ�صĻ��ϼ۵͡���һ�������£����ǻᷢ�����µ�ת��(��ϵʽδ��ƽ)��
��P��A�D��Q��B����L��O2�D��M��H2O����L��M�D��R��H2O����B��H2O�D��A��O2
(1)�����ֺ���Ԫ�ص������У���һ�������ᣬ�������� �������� ��
(2)��Ӧ�ڱ����ڴ���(������������)�����£����ȵ�һ���¶�ʱ���ܷ������˷�Ӧ�ڻ�������������Ҫ��;���ݴ��ƶ���ͬ��ͬѹ�£�������R�ܶȱȿ������ܶ�С����R�Ļ�ѧʽΪ ��
(3)ijͬѧд���������������������ת���Ĺ�ϵʽ��
��.M��P�D��N2O3��H2O
��.N2O4��H2O�D��P��Q
��.M��L�D��Q��H2O
����һ��������ʵ�ֵ��� �������� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�Ӻ�ˮ�п�����ȡ�壬��Ҫ��ӦΪ��2Br����Cl2===2Cl����Br2������˵����ȷ����(����)
| A�������Ӿ��������� | B�������ǻ�ԭ�� |
| C���÷�Ӧ���ڸ��ֽⷴӦ | D�������������Ա��嵥��ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��16�֣���2012?ɽ����ƫ��������N2O4�dz��õĻ���ƽ��������߷������»�ѧ��Ӧ��
��CH3��2NNH2��l��+2N2O4��l���T2CO2��g��+3N2��g��+4H2O��g��������
��1����Ӧ���������������� ����
��2������к��г��ֺ���ɫ���壬ԭ��Ϊ��N2O4��g��?2NO2��g��������
���¶�����ʱ��������ɫ�����Ӧ����Ϊ�� ��������ȡ����ȡ�����Ӧ��
��3��һ���¶��£���Ӧ�����ʱ�Ϊ��H���ֽ�1mol N2O4����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬������ ����������ͬ�¶��£�������Ӧ�������Ϊ1L�ĺ����ܱ������н��У�ƽ�ⳣ���� ������������䡱��С��������Ӧ3s��NO2�����ʵ���Ϊ0.6mol����0��3s�ڵ�ƽ����Ӧ����v��N2O4��=�� �� mol/��L?s����1��
��4��NO2���ð�ˮ��������NH4NO3��25��ʱ����a mol NH4NO3����ˮ����Һ�����ԣ�ԭ���� ���������ӷ���ʽ��ʾ���������Һ�μ�b L ��ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫�� ��������������������ƶ������μӰ�ˮ��Ũ��Ϊ mol?L��1����NH3?H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5 mol?L��1��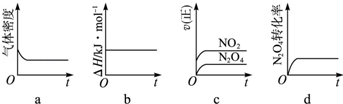
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�Ͼ�Ӳ�ʺϽ��к�̼����(WC)��������(Co)�����������������õ�ⷨ�ɻ���WC��Co���������̼�ͼ���£�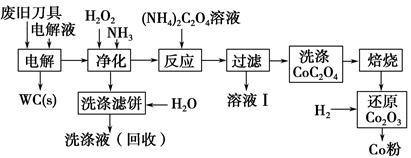
(1)���ʱ�Ͼɵ������������������������HCl��ҺΪ���Һ��������Ҫ�ĵ缫��ӦʽΪ ��
(2)�������������˱�����Ҫ�ɷ��� �����յ�ϴ��Һ����ˮ���Ƶ��Һ��Ŀ���ǻ����������е� ��
(3)��Һ�����Ҫ�ɷ��� ��ϴ��CoC2O4����ֶ����ղ�Ʒ���Ȳ�������Ӱ�죬������ʱ����ɻ�����Ⱦ��ԭ���� ��
(4)��Co2O3��ԭ��Co�۵Ļ�ѧ��Ӧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)�뽫�����������ʣ�KBr��Br2��I2��KI��K2SO4�ֱ��������к����ϣ����һ��δ��ƽ�Ļ�ѧ����ʽ��
KBrO3�� ��H2SO4���� �� �� �� ��H2O��
(2)����û�ѧ����ʽ��I2��KBr�Ļ�ѧ�������ֱ���8��1�����Br2�Ļ�ѧ�������� ��
���뽫��Ӧ��Ļ�ѧʽ����ƽ��Ļ�ѧ����������������Ӧ��λ���У�
KBrO3�� �� H2SO4����������
����ת��10 mol���ӣ���Ӧ������I2�����ʵ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������ԭ��Ӧ�ۺ�Ӧ�ã�������ԭ��Ӧ�ζ�
(1)��ƽ������ԭ��Ӧ����ʽ��
C2O42���� MnO4���� H��= CO2���� Mn2���� H2O
(2)��ȡ6.0 g��H2C2O4��2H2O��KHC2O4��K2SO4����������ˮ�ܽ⣬���250 mL��Һ����ȡ���ݴ���Һ��25 mL���ֱ�����������ƿ�С�
�ٵ�һ����Һ�м����̪��Һ���μ�0.25 mol��L��1 NaOH��Һ��20 mLʱ����Һ����ɫ��Ϊdz��ɫ������Һ���к͵�H���������ʵ���Ϊ mol��
�ڵڶ�����Һ�еμ�0.10 mol��L��1�����Ը��������Һ��
A��KMnO4��Һ�ڵζ��������� (�����������ԭ����)���õζ����� (���Ҫ������Ҫ��)����ָʾ��������16 mLʱ��Ӧ��ȫ����ʱ��Һ��ɫ�� ��Ϊ ��
B�����ڽӽ��յ�ʱ������������ˮ����ƿ��ϴһ�£��ټ����ζ����յ㣬�������� (�ƫ����ƫС������Ӱ�족)��
C�����ڴﵽ�ζ��յ�ʱ���Ӷ����������ý�� (�ƫ����ƫС������Ӱ�족)��
��ԭ������H2C2O4��2H2O����������Ϊ ��KHC2O4����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������ԭ��Ӧ��������������Ӧ�ù㷺������KMnO4��H2O2��Fe��NO3��3����Ҫ��������������ѧ֪ʶ�ش����⣺
��1����ϡ�����У�KMnO4�ܽ�H2C2O4����ΪCO2���÷�Ӧ�Ļ�ѧ����ʽΪ ����Ӧ������1mol��MnO4��ʱת�Ƶ�����Ϊ ��
��2��ȡ300mL 0��2mol/L��KI��Һ��һ����������KMnO4��Һǡ�÷�Ӧ�����ɵ����ʵ�����I2��KIO3��������KMnO4�����ʵ������� mol��
��3����Fe��NO3��3��Һ�м���Na2SO3��Һ����Һ�����ػ�ɫ��Ϊdz��ɫ����һ���ֱ�Ϊ�ػ�ɫ����Һ�ȱ�Ϊdz��ɫ�����ӷ���ʽ�� ���ֱ�Ϊ�ػ�ɫ��ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
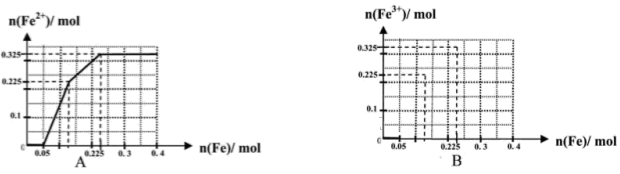
��һ����8�֣��ں������ʵ�����Ϊ0.1 mol FeCl3��H2SO4��Cu(NO3)2����Һ500 mL�У��������ۣ���Һ��n(Fe2��)�����n(Fe)�Ĺ�ϵ��ͼA(��ע��ʶͼ������ͼ��ÿС������Ϊ0.05mol)������ʾ����������ˮ�������Ӱ�죻��������������ԭʱ��������һ���������壩
��1��д��ͼ��n(Fe)��0.125mol-0.225 mol�ζ�Ӧ��Ӧ�����ӷ���ʽ____��
��2��д��ͼ��n(Fe)��0-0.05 mol�ζ�Ӧ��Ӧ�����ӷ���ʽ____��
��3������ͼB�л�����Һ��n(Fe3��)�����n(Fe)�ı仯��ϵͼ
��4������Ӧ���е����ȡ����Һ2mL�����Թ��У�Ϊ��֤������Һ����NO3�����ڣ��������Թ����ڵμ�_______��
| A������KMnO4��Һ | B�����������KSCN��Һ | C����ˮ | D������������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��.�ס���Ԫ�صĵ��ʺͻ�����Ӧ�ù㷺��
��1����Ԫ�ص�ԭ�ӽṹʾ��ͼ�� ��
��2��������뽹̿��ʯӢɰ���,�ڵ�¯�м��ȵ�1 500 �����ɰ���,��ӦΪ:
2Ca3��PO4��2+6SiO2 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10 P4+10CO
P4+10CO
ÿ����1 mol P4ʱ,���� mol���ӷ���ת�ơ�
��3����������ƣ�Na2S2O3���dz��õĻ�ԭ������ά����C����ѧʽC6H8O6����ˮ��Һ�м������I2��Һ,ʹά����C��ȫ����,ʣ���I2��Na2S2O3��Һ�ζ�,�ɲⶨ��Һ��ά����C�ĺ����������ķ�ӦΪ:
C6H8O6+I2 C6H6O6+2H++2I-
C6H6O6+2H++2I-
2S2 +I2
+I2 S4
S4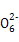 +2I-
+2I-
��һ�������ijά����C��Һ�м���a mol/L I2��ҺV1 mL,��ַ�Ӧ��,��Na2S2O3��Һ�ζ�ʣ���I2,����b mol/L Na2S2O3��ҺV2 mL������Һ��ά����C�����ʵ����� mol��
��4����������Һ��,����أ�KIO3�����������ƿɷ������·�Ӧ:
2I +5S
+5S +2H+
+2H+ I2+5S
I2+5S +H2O
+H2O
���ɵĵ�����õ�����Һ����,���ݷ�Ӧ��Һ������ɫ�����ʱ���������÷�Ӧ�����ʡ�
ijͬѧ���ʵ�����±���ʾ:
| | 0.01 mol/LKIO3������Һ�������ۣ������/mL | 0.01 mol/LNa2SO3��Һ�����/mL | H2O�����/mL | ʵ���¶�/�� | ��Һ������ɫʱ����ʱ��/s |
| ʵ��1 | 5 | V1 | 35 | 25 | |
| ʵ��2 | 5 | 5 | 40 | 25 | |
| ʵ��3 | 5 | 5 | V2 | 0 | |
 Ce��OH��4��+ ��
Ce��OH��4��+ ���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com