
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
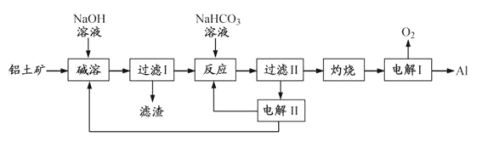
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为___。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH___(填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___。冰晶石的作用是___。
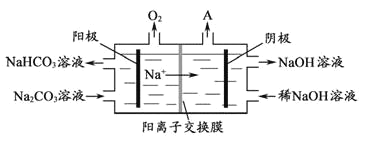
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阴极产生的物质A的化学式为___;电解时,若阴极生成标况下44.8L的A,则阳极产生NaHCO3的质量为___g。
【答案】Al2O3+2OH-→H2O+2AlO2- 减小 石墨电极被阳极上产生的氧气氧化 作助熔剂,降低电解液工作时的温度 H2 336
【解析】
结合流程及题中信息可知,铝土矿在碱溶时,其中的Al2O3和SiO2可与强碱溶液反应,二氧化硅和强碱溶液反应后转化为沉淀,氧化铝和氢氧化钠反应后得到可溶于水的偏铝酸钠,过滤后,滤液中的NaAlO2与NaHCO3反应生成氢氧化铝沉淀和Na2CO3,氢氧化铝经灼烧后得到Al2O3,最后电解熔融的Al2O3得到铝。Na2CO3溶液经电解后可以再生成NaHCO3和NaOH进行循环利用,据此分析解答。
(1)“碱溶”时,铝土矿中的Al2O3和SiO2能够与氢氧化钠反应,其中生成偏铝酸钠的离子方程式为Al2O3+2OH-→H2O+2AlO2-,故答案为:Al2O3+2OH-→H2O+2AlO2-;
(2)“过滤Ⅰ”所得滤液中主要含有偏铝酸钠和氢氧化钠,加入NaHCO3溶液,三者反应生成氢氧化铝沉淀和碳酸钠,溶液的碱性减弱,pH减小,故答案为:减小;
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中,阳极上生成氧气,能够氧化石墨生成二氧化碳,因此作阳极的石墨易消耗。氧化铝的熔点很高,加入冰晶石,冰晶石作助熔剂,可以降低电解液工作时的温度,故答案为:石墨电极被阳极上产生的氧气氧化;作助熔剂,降低电解液工作时的温度;
(4)“电解Ⅱ”是电解Na2CO3溶液,阳极上是溶液中的氢氧根离子放电生成氧气4OH--4e-=2H2O+O2↑,阴极上是溶液中的氢离子放电生成氢气,2H++2e-=H2↑或2H2O+2e- = H2↑+ 2OH-;若阴极生成标况下44.8L的氢气,氢气的物质的量为![]() =2mol,转移4mol电子,阳极上有4mol氢氧根离子放电,则阳极产生4molNaHCO3,质量为4mol×84g/mol=336g,故答案为:H2;336。
=2mol,转移4mol电子,阳极上有4mol氢氧根离子放电,则阳极产生4molNaHCO3,质量为4mol×84g/mol=336g,故答案为:H2;336。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_______________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用如图装置 来测定过氧化钠的质量分数。

①A中发生反应离子方程式为___________________
②将仪器连接好以后,必须进行的第一步操作是__________
③写出装置C中发生的所有反应的化学方程式______________________________,_______________________________________________________
④D中NaOH溶液的作用__________________________
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分 数为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
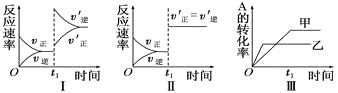
A. 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B. 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D. 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是

A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组利用易拉罐(主要成分是Al、Fe)制备明矾的过程如下图所示:

⑴ 写出“反应Ⅰ”时的离子反应方程式:________。
⑵ 写出“反应Ⅱ”时的化学反应方程式:________。
⑶ 过滤所得Al(OH)3需进行洗涤,检验Al(OH)3已洗涤干净的方法是:________。
⑷ 明矾能够净水的原因是________。
⑸ Fe和水蒸气在高温下反应后所得固体产物X可用于制取FeCl2溶液。请从下列试剂中选择合适的将X转化为FeCl2溶液。试剂:盐酸、NaCl溶液、Cu粉、Fe粉。依次选用的试剂为:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锂广泛应用于陶瓷和医药等领域,在水中的溶解度比较小。以锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)为原料制备Li2CO3的流程如图:
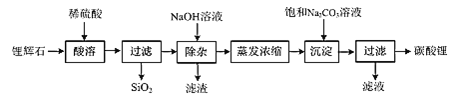
⑴写出“酸溶”时Li2O发生反应的离子方程式:______。
⑵“除杂”时所用NaOH溶液不能过量,原因是______。
⑶“除杂”时检验铁元素已完全除去的方法是______。
⑷写出“沉淀”时反应的化学方程式:______。
⑸检验最终所得碳酸锂样品中是否含有Na2CO3的方法是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求填写下列空白:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________________________________________;
(2)写出元素②的最简单氢化物的结构式_________________________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体[NH4Fe(SO4)2·6H2O]的一种方案如下:
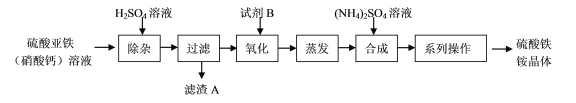
下列说法不正确的是
A. 滤渣A的主要成分是CaSO4
B. 相同条件下,NH4Fe(SO4)2·6H2O净水能力比FeCl3强
C. “合成”反应要控制温,温度过高,产率会降低
D. “系列操作”包括蒸发浓缩、降温结晶、过滤、干燥等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com