
【题目】标准NaOH溶液滴定盐酸实验中,不必用到的是( )
A.酚酞B.圆底烧瓶C.锥形瓶D.滴定管
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制城法”生产纯碱和化肥NH4Cl.工艺流程如图所示。下列有关说法不正确的是

A. 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B. 粗盐可采用除杂和重结晶等过程提纯
C. 流程图中的系列操作中用到的玻璃仪器可能有玻璃棒、烧杯、漏斗、坩埚等
D. 该流程中得到的晶体用到了溶解度的差异性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
(1)所含铁元素既有氧化性又有还原性的物质是______(用字母代号填).
A.FeB.FeCl3C.FeSO4D.Fe2O3
(2)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是______nm.
(3)检验溶液中Fe3+存在的试剂是______(填物质名称),证明Fe3+存在的现象是______.电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:______.
(4)若要验证溶液中不含Fe3+而只含有Fe2+,正确的实验操作方法及现象是______.
(5)欲从制造印刷电路板的废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
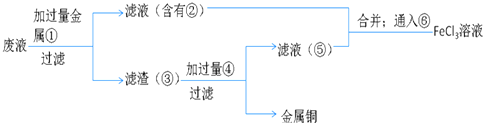
A.请写出上述实验中加入或生成的有关物质的化学式:
①______④______
B.请写出通入⑥反应的离子方程式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使反应顺利进行,则可以从长颈漏斗中加入的试剂是 ( )
①食盐水②KNO3溶液③适量硫酸铜溶液④Na2CO3溶液⑤CCl4 ⑥浓氨水
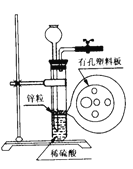
A. ①②④ B. ②⑥ C. ②③⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中氧原子数目与6.8gH2O2中氧原子数目一定相等的是( )
A.6.72L CO
B.6.6gCO2
C.8gSO3
D.9.8gH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2,该反应可表示为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O。下列说法中,不正确的是
A. 反应中氮元素被氧化,氯元素被还原
B. 还原性NH4+< Cl-
C. 反应中每生成1 mol N2,转移6 mol电子
D. 经此法处理过的废水不可以直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将溶质的质量分数为a%、物质的量浓度为c1mol/L的稀硫酸加热蒸发掉一定量的水,使质量分数为2a%,此时硫酸的物质的量浓度为c2 mol/L.已知硫酸浓度越大,密度越大,则c1 与c2的数值关系是( )
A.c1=2c2
B.c2=2cl
C.c2>2c1
D.c2<2cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有短周期X、Y、Z、M、W为五种短周期元素.其中X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L﹣1;W的质子数是X、Y、Z、M四种元素质子数之和的一半.下列说法正确的是( )
A.原素Z,W的简单离子的电子层结构不同
B.Y的最高价氧化物的水化物能与其简单气态氢化物反应生成盐且显碱性
C.由X元素形成的单质不一定是原子晶体
D.由X,YCZ,M四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成份为FeO.Cr2O3 , 还含有Al2O3、SiO2等杂质)为主要原料生产红矾钠晶体(Na2Cr2O7 . 2H2O),其主要工艺流程如图: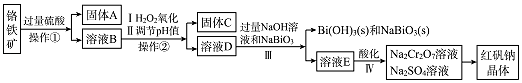
已知:NaBiO3在碱性条件下能将Cr3+氧化为CrO42﹣ .
(1)固体A为
(2)实验室中操作①②的名称为
(3)固体C中含有的物质是Al( OH)3和Fe(OH)3 , 则H2 O2的作用是 .
已知:KsP[Fe(OH)3]=3.0×10﹣39 , KsP[Al(OH)3]=1×10﹣33 , 当pH=5.6时Cr(OH)3开始沉淀.室温下,Ⅱ中需调节溶液pH范围为(杂质离子浓度小于1×10﹣6mol/L视为沉淀完全).
(4)写出Ⅲ中发生反应的离子方程式 .
(5)Ⅳ中酸化是用硫酸而不用盐酸酸化,理由是(结合化学方程式回答);工业上也可设计如图示装置,用锂离子电池(LixC+Li1﹣xCoO2 ![]() C+LioO2 , LixC为难电离锂碳化合物)为电源,电解Na2CrO4溶液制取Na2Cr2O7 , 该装置工作时E电极的名称是极;电源的A极的电极反应式为 . 当电解过程中转移了0.5mol电子时,理论上右侧溶液的质量减少 g.
C+LioO2 , LixC为难电离锂碳化合物)为电源,电解Na2CrO4溶液制取Na2Cr2O7 , 该装置工作时E电极的名称是极;电源的A极的电极反应式为 . 当电解过程中转移了0.5mol电子时,理论上右侧溶液的质量减少 g.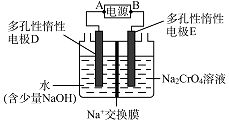
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com