
【题目】下列物质中氧原子数目与6.8gH2O2中氧原子数目一定相等的是( )
A.6.72L CO
B.6.6gCO2
C.8gSO3
D.9.8gH2SO4
【答案】D
【解析】解:6.8gH2O2的物质的量为: ![]() =0.2mol,含有0.4molO原子,根据N=nNA可知,含有O原子个数相同,则含有O原子物质的量相同,A.没有指出标准状况下,无法计算CO的物质的量,故A错误;
=0.2mol,含有0.4molO原子,根据N=nNA可知,含有O原子个数相同,则含有O原子物质的量相同,A.没有指出标准状况下,无法计算CO的物质的量,故A错误;
B.6.6g二氧化碳的物质的量为: ![]() =0.15mol,含有O的物质的量为:0.15mol×2=0.3mol,故B错误;
=0.15mol,含有O的物质的量为:0.15mol×2=0.3mol,故B错误;
C.8gSO3的物质的量为: ![]() =0.1mol,含有0.3mol氧原子,故C错误;
=0.1mol,含有0.3mol氧原子,故C错误;
D.9.8gH2SO4的物质的量为: ![]() =0.1mol,含有0.4mol氧原子,故D正确;
=0.1mol,含有0.4mol氧原子,故D正确;
故选D.
根据n= ![]() 计算出6.8gH2O2的物质的量,然后可知含有氧原子的物质的量,根据N=nNA可知,含有O原子个数相同,则含有O原子物质的量相同,根据n=
计算出6.8gH2O2的物质的量,然后可知含有氧原子的物质的量,根据N=nNA可知,含有O原子个数相同,则含有O原子物质的量相同,根据n= ![]() 对各选项进行计算即可.
对各选项进行计算即可.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: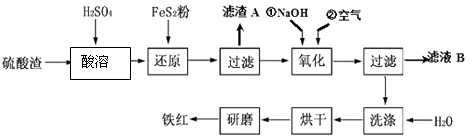
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为;“滤渣A”主要成份的化学式为 .
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+ , 而本身被氧化为H2SO4 , 请完成该反应的离子方程式:FeS2+14Fe3++H2O═15Fe2++SO ![]() + .
+ .
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 .
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) .
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列所示实验装置制取乙酸乙酯.回答以下问题: 
(1)在大试管中先加入3mL , 然后一边摇动一边慢慢地加入2mL和2mL乙酸,混合均匀,然后加入几粒碎瓷片.按上图连好装置,用酒精灯对大试管小心均匀加热.当观察到明显现象时停止实验.
(2)与书中采用的实验装置的不同之处是:这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中.在此处球形干燥管的作用除了使乙酸乙醋充分冷凝外还有;
(3)有甲、乙、丙三位同学,分别将乙酸与乙醉反应得到的酯(未用饱和Na2CO3溶液承接)提纯,在未用指示剂的情况下,他们都是先加NaOH中和过量的酸,然后用蒸馏法将酯分离出来.但他们的结果却不同: ①甲得到了不溶于水的中性酯;②乙得到显酸性的酯的混合物;③丙得到大量水溶性物质.
试判断三位同学加入的NaOH是多了还是怡好还是少了(填“少量”、“适量”、“过量“)
①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能减慢化学反应速率的是( )
A.用Zn和2molL﹣1H2SO4反应制取H2时,向溶液中滴加少量CuSO4溶液
B.日常生活中,将食物贮藏在冰箱中
C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末
D.用相同质量的锌粉替代锌粒与同浓度、同体积的盐酸反应制氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型,据此回答下列问题:
(1)同物质的量的A、B、C、D燃烧,耗氧量最大的是(填对应字母); 同质量的A、B、C、D燃烧,耗氧量最大的是(填对应字母);
(2)所有原子都在同一平面上的是(填对应字母);
(3)能使酸性高锰酸钾褪色的是(填对应字母);
(4)写出C发生聚合反应的化学方程式;
(5)写出实验室制取D的化学方程式;
(6)写出G和硝酸反应的化学方程式 . 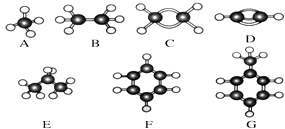
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):++═+
(2)整个过程中的还原剂是
(3)把KI换成KBr,则CCl4层变为色:继续滴加氯水,CCl4层的颜色没有变化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 .
(4)加碘盐中含碘量为20mg~50mg/kg.制取加碘盐(含KIO3的食盐)1000kg,若庄Kl与Cl2反应制KIO3 , 至少需要消耗Cl2L(标准状况,保留2位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳的氧化物直接合成乙醇燃料已进入大规模生产.
(1)如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g)△H;若密闭容器中充有10molCO与20molH2 , 在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如图1所示. 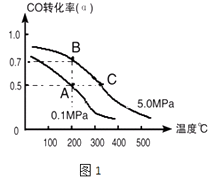
已知:2CO(g)+O2(g)═2CO2(g)△H1=﹣566kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H2=﹣572kJmol﹣1
CH3CH2OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=﹣1366kJmol﹣1
H2O(g)═H2O(l)△H4=﹣44kJmol﹣1
①△H=kJmol﹣1
②若A、C两点都表示达到的平衡状态,则从反应开始到达平衡状态所需的时间tAtC(填“>”、“<”或“﹦”).
③若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=;
④熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)格负极燃气,空气与CO2的混合气为正极助燃气,用一定比例Li2CO3和Na2CO3低熔混合物为电解质,以金属镍(燃料极)为催化剂制成的.负极上CO反应的电极反应式为 .
(2)工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数.请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是: .
(3)目前工业上也可以用CO2来生产甲醇.一定条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g).若将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2所示(实线). 
①请在图中绘出甲醇的物质的量随时间变化曲线.
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 , 曲线Ⅱ对应的实验条件改变是 .
(4)将标准状况下4.48L CO2通入1L 0.3molL﹣1NaOH溶液中完全反应,所得溶液中微粒浓度关系正确的是 A.c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3)
B.c(OH﹣)+c(CO32﹣)=c(H2CO3)+c(H+)
C.c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣)
D.2c(Na+)=3c(HCO3﹣)+3c(CO32﹣)+3c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com