
【题目】X、Y、Z、W、Q、R为原子序数依次增大的前四周期元素。其相关信息如下表:
元素代号 | 相关信息 |
X | 原子核外电子总数与周期序数相等 |
Y | 原子核外电子占3个不同能级,且每个能级上排布的电子数相同 |
Z | 最简单气态氢化物能使湿润的红色石蕊试纸变蓝 |
W | 原子的L电子层上有2对成对电子 |
Q | 元素的最高正价与最低负价的代数和为6 |
R | 单质是日常生活中用途最广、用量最大的金属材料 |
请回答下列问题:
(1(1)基态R原子的核外电子排布式为________,R与YW易形成配合物R(YW)5,在R(YW)5中R 的化合价为_________。
(2)Y、Z、W三种元素的电负性由小到大的顺序为_________(用元素符号表示)。
(3)基态Q原子的最高能层具有的原子轨道数为________。
(4)下列关于Y2X2的说法中正确的是______(填字母)。
A. Y2X2中的所有原子都满足8电子稳定结构
B.每个Y2X2分子中σ键和π键数目之比为1:1
C. Y2X2是由极性键和非极性键构成的非极性分子
D. Y2X2的分子构型为直线形
(5)ZQ3中心原子的杂化轨道类型为______,其分子空间构型为_______。
【答案】 ls22s22p63s23p63d64s2(或[Ar]3d64s2) 0 C<N<O 9 CD sp3 三角锥形
【解析】X的原子核外电子总数与周期序数相等则X为氢元素;Y的元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同,则核外电子排布为1s22s22p2,则Y为碳元素;Z最简单气态氢化物能使湿润的红色石蕊试纸变蓝,则Z为氮元素;W原子的L电子层上有2对成对电子,价电子排布式为2s22p4,则W为O元素;Q元素的最高正价与最低负价的代数和为6,则Q为氯元素;R的单质是日常生活中用途最广、用量最大的金属材料,则R为Fe元素;
(1)铁的核电荷数为26,其基态原子的核外电子排布式为ls22s22p63s23p63d64s2(或[Ar]3d64s2),Fe与CO易形成配合物Fe(CO)5,根据正负化合价代数和为0,其中C为+2价、O为-2价,可知Fe(CO)5中Fe的化合价为0;
(2)C、N、O三种元素非金属性越强,其电负性越大,则电负性由小到大的顺序为C<N<O;
(3)基态Cl原子的最高能层为3,该能层有3s、3p、3d能级,分别 有1、3、5个轨道,共有轨道数为9;
(4)A. C2H2的电子式为![]() ,H原子不满足8电子稳定结构,故A错误;B.C2H2的结构简式为
,H原子不满足8电子稳定结构,故A错误;B.C2H2的结构简式为![]() ,分子中σ键和π键数目之比为3:2,故B错误;C. C2H2的结构简式为
,分子中σ键和π键数目之比为3:2,故B错误;C. C2H2的结构简式为![]() ,则C2H2分子是由极性键和非极性键构成的非极性分子,故C正确;D. C2H2的分子中碳原子为sp杂化,为直线形分子,故D正确;答案为CD;
,则C2H2分子是由极性键和非极性键构成的非极性分子,故C正确;D. C2H2的分子中碳原子为sp杂化,为直线形分子,故D正确;答案为CD;
(5)类比NH3可推知NCl3中心原子杂化方式为sp3杂化,NCl3的空间构型为三角锥形。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是( )
4NO(g)+ 6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24mL浓度为 0.05mol/L 的Na2SO3溶液,恰好与 20mL浓度为0.02mol/L的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是( )
A. +6 B. +3 C. +2 D. 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备丙烯腈(CH2=CHC≡N)的绿色工艺有乙炔法。
乙炔法:![]()
(1)下列说法正确的是____________(不定项选择):
a. NH4+空间构型呈正四面体
b. CH2=CHCN分子中只有碳、氢原子位于同一平面
c. C2H2、HCN分子中所有原子均位于同一直线
d. NH3极易溶于H2O,主要是因为它们都是极性分子
(2)与NH3互为等电子体的阳离子为______________(写化学式)。
(3)1mol丙烯腈分子中含有![]() 键的数目为__________________。
键的数目为__________________。
(4)铜能与浓盐酸缓慢发生置换反应产生氢气,有配合物H[CuCl2]生成。该反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列有关CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_________________________________(用离子方程式表示)。
已知:AlF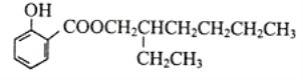 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子中存在的化学键类型________,OF2的电子式________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1 。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是可以综合利用的。从海水中提取食盐和溴的过程如下:
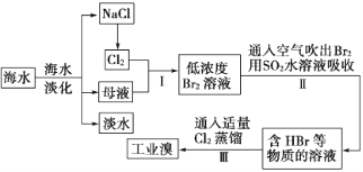
(1)请写出一种海水淡化的方法:_______________。
(2)步骤Ⅰ从母液中获取Br2的离子方程式为:_______________________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提纯含有少量Ba(NO3)2杂质的KNO3溶液,可使用的方法为
A.加入过量Na2CO3溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量K2SO4溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量Na2SO4溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量K2CO3溶液,过滤,除去沉淀,溶液中补加适量硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
水杨酸酯E为紫外吸收剂,可用于配制防晒霜。E的一种合成路线如下:
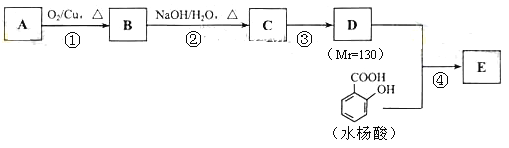
请回答下列问题:
(1)一元醇A中氧的质量分数约为21.6%。则A的分子式为 ;结构分析显示A只有一个甲基,A的名称为 。
(2)B能与新制的Cu(OH)2发生反应,该反应的化学方程式为 。
(3)C有 种结构;若一次取样,检验C中所含官能团,按使用的先后顺序写出所用试剂 ;
(4)第③的反应类型为 ;D所含官能团的名称为 。
(5)写出同时符合下列条件的水杨酸所有同分异构体的结构简式: 。
A、分子中含有6个碳原子在一条线上
B、分子中所含官能团包括水杨酸具有的官能团
(6)第④步的反应条件为 ;写出E的结构简式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com