
����Ŀ��������Ȼ���г���CaF2����ʽ���ڡ�
(1)�����й�CaF2�ı�����ȷ����________��
a��Ca2����F��������ھ�����������
b��F�������Ӱ뾶С��Cl������CaF2���۵����CaCl2
c���������ӱ�Ϊ2��1�����ʣ�����CaF2���幹����ͬ
d��CaF2�еĻ�ѧ��Ϊ���Ӽ������CaF2������״̬���ܵ���
(2)CaF2������ˮ���������ں�Al3������Һ�У�ԭ����_________________________________(�����ӷ���ʽ��ʾ)��
��֪��AlF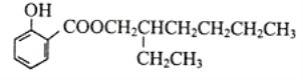 ����Һ�п��ȶ����ڡ�
����Һ�п��ȶ����ڡ�
(3)F2ͨ��ϡNaOH��Һ�п�����OF2��OF2�����д��ڵĻ�ѧ������________��OF2�ĵ���ʽ________��
(4)F2������±�ص��ʷ�Ӧ�����γ�±�ػ��������ClF3��BrF3�ȡ���֪��ӦCl2(g)��3F2(g)===2ClF3(g)����H����313 kJ��mol��1��F��F���ļ���Ϊ159 kJ��mol��1��Cl��Cl���ļ���Ϊ242 kJ��mol��1����ClF3��Cl��F����ƽ������Ϊ________kJ��mol��1 ��ClF3���ۡ��е��BrF3��________(����������������)��
���𰸡� b��d 3CaF2��Al3��===3Ca2����AlF63- ���ۼ� ![]() 172 ��
172 ��
��������(1)a���������Ӽ���ھ��������;��������Ca2+��F-����ھ����������ã������ھ����������a����b�����Ӿ�����۵�������������ɡ����Ӱ뾶�йأ����Ӱ뾶ԽС�����Ӿ�����۵�Խ�ߣ�����CaF2���۵����CaCl2����b��ȷ��c������Ľṹ���ɱȡ��뾶���йأ��������ӱ�Ϊ2��1�����ʣ���CaF2����ĵ�ɱ���ͬ�����뾶�����ϴ����幹�Ͳ���ͬ����c����d��CaF2�еĻ�ѧ��Ϊ���Ӽ������ӻ�����������ʱ�ܷ������룬���������ƶ������ӣ��ܵ��磬���CaF2������״̬���ܵ��磬��b��ȷ���ʴ�Ϊbd��
(2)CaF2������ˮ���������ں�Al3+����Һ�У���Ϊ����Һ��F-��Al3+���γɺ��ѵ����������AlF63-��ʹCaF2���ܽ�ƽ�����ƣ��䷴Ӧ�����ӷ���ʽΪ��3CaF2+Al3+=3Ca2++AlF63-��
(3)OF2�����ǹ��ۻ�������ڹ��ۼ�(���Թ��ۼ�)��OF2�ĵ���ʽΪ![]() ��
��
(4)��H=��Ӧ����ܼ���-��������ܼ��ܣ���Cl-F����ƽ������ΪQkJmol-1��
��242+159��3-2��3��Q=-313�����Q=172����Է�������Խ���Ӿ�����۷е�Խ�ߣ���֪ClF3����Է���������BrF3��С������ClF3���ۡ��е��BrF3�ĵ͡�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п����ڼ���ʵ���Ҿ��õ�FeSO4��Һ�Ƿ���Fe3+���Լ���
A��ʯ����Һ B����̪��Һ C��������ˮ D��KSCN��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ǻ���̼ԭ����û����ԭ�ӵĴ����ܷ�����������Ӧ��A��һ����Ҫ�Ļ���ԭ�ϣ���������ΪC4H9Cl����������ת����ϵ�����ַ�Ӧ��������ȥ����
����F���ܷ�����������Ӧ��E��G���ܺ�����Cu(OH)2��Ӧ������Ӧ������ʵ�����������ͬ��H��һ���й���ζ��Һ�塣
��1��A��ͬ���칹����______�֣���������������A�ṹ��ʽΪ_________��
��2����١��߷�Ӧ������ͬ����___________������ţ�
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��A��B��________________��
E������Cu(OH)2��Ӧ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����

A. ˮ��ͭ���ӵ�ģ����ͼ1��ʾ��1��ˮ��ͭ�����к���4����λ��
B. K2O����ľ�����ͼ2��ʾ��ÿ��K2O����ƽ��ռ��8��O2-
C. ����Zn��Znԭ�Ӷѻ�ģ����ͼ3��ʾ���ռ�������Ϊ68%
D. ����Cu��Cuԭ�Ӷѻ�ģ����ͼ4��ʾ��Ϊ�����������ܶѻ���ÿ��Cuԭ�ӵ���λ����Ϊ8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڵ���ʵ���
A ��SO3 B ��Na2SO4 C��Cl2 D���ƾ���C2H5OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Q��RΪԭ���������������ǰ������Ԫ�ء��������Ϣ���±���
Ԫ�ش��� | �����Ϣ |
X | ԭ�Ӻ����������������������� |
Y | ԭ�Ӻ������ռ3����ͬ�ܼ�����ÿ���ܼ����Ų��ĵ�������ͬ |
Z | �����̬�⻯����ʹʪ��ĺ�ɫʯ����ֽ���� |
W | ԭ�ӵ�L���Ӳ�����2�ԳɶԵ��� |
Q | Ԫ�ص��������������۵Ĵ�����Ϊ6 |
R | �������ճ���������;��㡢�������Ľ������� |
��ش��������⣺
��1��1����̬Rԭ�ӵĺ�������Ų�ʽΪ________��R��YW���γ������R(YW)5,��R(YW)5��R �Ļ��ϼ�Ϊ_________��
��2��Y��Z��W����Ԫ�صĵ縺����С�����˳��Ϊ_________����Ԫ�ط��ű�ʾ����
��3����̬Qԭ�ӵ�����ܲ���е�ԭ�ӹ����Ϊ________��
��4�����й���Y2X2��˵������ȷ����______������ĸ����
A. Y2X2�е�����ԭ�Ӷ�����8�����ȶ��ṹ
B��ÿ��Y2X2������������������Ŀ֮��Ϊ1:1
C. Y2X2���ɼ��Լ��ͷǼ��Լ����ɵķǼ��Է���
D. Y2X2�ķ��ӹ���Ϊֱ����
��5��ZQ3����ԭ�ӵ��ӻ��������Ϊ______������ӿռ乹��Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
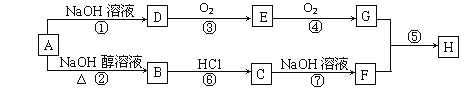
����Ŀ��������I��һ�ֹ������ܼ�����ϳ�·�����£�
��֪���� ��
��
��
�ش��������⣺
��l��A��B�ķ�Ӧ����Ϊ_________��
��2��D�к���������Ϊ_________��
��3��E+H��I�Ļ�ѧ����ʽΪ_________��
��4��J��D��ͬ���칹�壬��������������J�Ľṹ��______�֣������������칹����
�� �ܷ���������Ӧ
�� �ܷ���ˮ�ⷴӦ
���к˴Ź���������3 ��壬�ҷ����֮��Ϊ6:1:1�Ľṹ��ʽΪ_________��
��5���Ա���Ϊԭ�Ͽɺϳɻ�����N:
��Ӧ����l_________����Ӧ����2___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
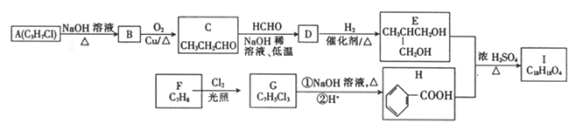
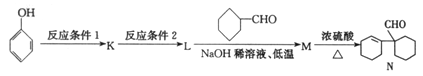
����Ŀ���л���A��G�Ľṹ��ʽ�ֱ�Ϊ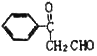 ��
��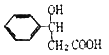 ��������һ����Ҫ���л��ϳ��м��壬D��FΪ�߷��ӻ����
��������һ����Ҫ���л��ϳ��м��壬D��FΪ�߷��ӻ����
��1��д���л���G���������ֺ��������ŵ�����_______________��
��2���л���G���Է�������ͼ��ת������ش��������⣺

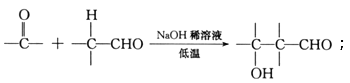
��ɷ�Ӧ��ѡ�õ��Լ�����Ϊ___________________________________________����Ӧ�ܵķ�Ӧ������___________________________________________��
д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ��____________________________________��
��Ӧ��____________________________________��
��Ӧ��____________________________________��
��3��G��һ��ͬ���칹��![]() ��һ��ҽҩ�м��塣����ƺ���������
��һ��ҽҩ�м��塣����ƺ���������![]() �ϳ�
�ϳ�![]() ������ԭ����ѡ���÷�Ӧ����ͼ��ʾ����ע����Ҫ�ķ�Ӧ������������:
������ԭ����ѡ���÷�Ӧ����ͼ��ʾ����ע����Ҫ�ķ�Ӧ������������: ![]()
__________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ��ơ��Ȼ�李��Ȼ������Ȼ�þ������Һ��ͨ��һ��ʵ����ܼ������𣬲�ֻ��һ���Լ��������Լ��ǣ�
A. NaOH B. HCl C. KSCN D. BaCl2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com