
【题目】针对下列9种元素,完成以下各小题
周期 | IA | ⅡA | ⅢA | ⅣA | ⅥA | ⅦA | O | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)常见单质为有色气体的元素是_______(填名称)。
(2)用电子式表示元素④和⑨形成化合物的过程_________。
(3)最高价氧化物对应的水化物中酸性最强的是_________(填化学式)。
(4)④和⑥两者的最高价氧化物对应的水化物反应的离子方程式为_______。
(5)⑦的单质的用途正确的是_____。
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(6)元素①和⑦非金属性较强的是____(填写元素符号),写出一个能表示二者非金属性强弱关系的化学方程式为:_______ 。
【答案】(1)氯 (2)![]() (3)HClO4
(3)HClO4
(4)Al(OH)3+OH-=AlO2-+2H2O(5)BD(6)C;Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
【解析】
试题根据元素在元素周期表的位置判断①为碳元素,②为氮元素,③为氧元素,④为钠元素,⑤为镁元素,⑥为铝元素,⑦为硅元素,⑧为硫元素,⑨为氯元素。(1)常温下,氯气为黄绿色气体,单质为有色气体的元素是氯。(2)氯化钠的形成过程为![]() 。(3)最高价氧化物对应的水化物中酸性最强的是HClO4。(4)氢氧化钠溶液与氢氧化铝反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-=AlO2-+2H2O。(5)硅单质可用作太阳能电池和计算机芯片,选BD。(6)同主族元素由上到下元素的非金属性逐渐减弱,碳元素和硅元素中非金属性较强的是C,元素的非金属性越强,最高价氧化物水化物的酸性越强,可利用反应:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓证明。
。(3)最高价氧化物对应的水化物中酸性最强的是HClO4。(4)氢氧化钠溶液与氢氧化铝反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-=AlO2-+2H2O。(5)硅单质可用作太阳能电池和计算机芯片,选BD。(6)同主族元素由上到下元素的非金属性逐渐减弱,碳元素和硅元素中非金属性较强的是C,元素的非金属性越强,最高价氧化物水化物的酸性越强,可利用反应:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓证明。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】某研究小组同学在实验室用卤块制备少量Mg(ClO3)2·6H2O,其流程如图所示:
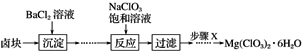
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)的变化曲线如图所示。

③形成氢氧化物沉淀时,不同离子对应溶液的pH如下:Fe2+开始沉淀的pH为5.8,完全沉淀的pH为8.8;Fe3+开始沉淀的pH为1.1,完全沉淀的pH为3.2;Mg2+开始沉淀的pH为8.2,完全沉淀的pH为11。
④可选用的试剂:H2O2、稀硫酸、KMnO4溶液、MgCl2溶液、MgO。
(1)步骤X包含的操作为___________、 ___________、____________、过滤洗涤并干燥。
(2)加入BaCl2溶液沉淀后需经过两步实验步骤才进行下步反应,请写出这两步实验步骤:
①________________________________________________________________________;
② _______________________________________________________________________;
(3)加入NaClO3饱和溶液发生反应的化学方程式为_______________________________。
(4)将Mg(ClO3)2加入到含有KSCN的FeSO4溶液中立即出现红色,写出相关反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:Fe2+>Br-。向100mLFeBr2溶液中通入3.36L(标准状况)Cl2,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原溶液中FeBr2的物质的量浓度为( )
A. 2 mol·L-1 B. 1.5 mol·L-1 C. 1 mol·L-1 D. 0.75 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中两种物质作用时,反应条件或反应物用量改变,对生成物没有影响的是
A. Na与O2 B. NaOH溶液与CO2
C. Na2O2与CO2 D. AlCl3溶液与NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为_______。
(2)高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
① Na2FeO4中铁元素的化合价是______价。
② 用Na2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是_______(用离子方程式表示)。
③ 工业上可用FeCl3、NaOH 、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:2FeCl3 +10NaOH+3NaClO=2_____+5_____+9_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaAlO2、Ba(OH)2、NaOH配成100.0 mL混合溶液,向该溶液中通入足量CO2,生成沉淀的物质的量n(沉淀),与通入CO2的物质的量n(CO2)的关系,如图所示,下列说法中正确的是

A. P点的值为0.6
B. 混合溶液中c(NaOH)+c(NaAlO2)=4.0 mol/L
C. bc段的化学反应方程式为:NaOH+CO2=NaHCO3
D. cd段表示Al(OH)3沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如下:

已知:正丁醇沸点118℃,纯邻苯二甲酸二丁酯是无色透明、具有芳香气味的油状液体,沸点340℃,酸性条件下,温度超过180℃时易发生分解,邻苯二甲酸酐、正丁醇、邻苯二甲酸二丁酯实验操作流程如下:

①三颈烧瓶内加入30g邻苯二甲酸酐16g正丁醇以及少量浓硫酸。
②搅拌,升温至105℃,持续搅拌反应2小时,升温至140℃。搅拌、保温至反应结束。
③冷却至室温,将反应混合物倒出,通过工艺流程中的操作X,得到粗产品。
④粗产品用无水硫酸镁处理至澄清→取清液(粗酯)→圆底烧瓶→减压蒸馏
请回答以下问题:
(1)仪器a的名称______________,邻苯二甲酸酐、正丁醇和浓硫酸的加入顺序有严格的要求,请问浓硫酸是在_____________(填最前、最后或中间)加入。
(2)步骤②中不断从分水器下部分离出产物水的目的是____________,判断反应已结束的方法是_______________。
(3)反应的第一步进行得迅速而完全,第二步是可逆反应,进行较缓慢,为提高反应速率,可采取的措施是:___________________。
A.增大压强 B.增加正丁醇的量 C.分离出水 D.加热至200℃
(4)操作X中,应先用5%Na2CO3溶液洗涤粗产品,纯碱溶液浓度不宜过高,更不能使用氢氧化钠,若使用氢氧化钠溶液,对产物有什么影响?(用化学方程式表示):____________________________。
(5)粗产品提纯流程中采用减压蒸馏的目的是____________________________。
(6)用测定相对分子质量的方法,可以检验所得产物是否纯净,现代分析方法中测定有机物相对分子质量通常采用的仪器是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.卤水点豆腐和静电除尘都应用了胶体聚沉的性质
B.工业上常利用铝热反应冶炼难熔的金属,如钒、铬、锰等
C.合金的熔点一般比组成成分的金属熔点都高
D.水泥、玻璃、陶瓷等硅酸盐工业产品的共同原料为石灰石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氨的下列叙述中,正确的是( )
A. 氨因为有刺激性气味,因此不用来作制冷剂
B. 氨具有还原性,可以被氧化为NO
C. 氨极易溶于水,因此氨水比较稳定(不容易分解)
D. 氨溶于水显弱碱性,因此可使石蕊试液变为红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com