
【题目】对氯苯氧乙酸是一种具有生长素活性的苯氧类植物生长调节剂。实验室合成原理为:![]() +ClCH2COOH+2NaOH
+ClCH2COOH+2NaOH![]() +NaCl+H2O
+NaCl+H2O
![]() +HCl
+HCl![]() +NaCl
+NaCl
制备过程存在副反应:ClCH2COOH+2NaOH![]() HOCH2COONa+NaCl+H2O
HOCH2COONa+NaCl+H2O
已知相关物质的物理性质:
名称 | 氯乙酸 | 对氯苯酚 | 对氯苯氧乙酸 |
性状 | 无色晶体 | 无色晶体 | 白色晶体 |
水 | 易溶 | 极微溶 | 微溶 |
乙醇 | 易溶 | 溶 | 易溶 |
乙醚 | 易溶 | 溶 | 易溶 |
主要实验装置和步骤如下:
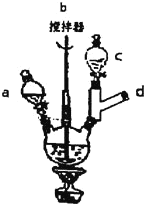
Ⅰ.合成:在三颈烧瓶中加入10mL20%的NaOH溶液、6.4g对氯苯酚和0.5gKI。称取5.3g氯乙酸溶于蒸馏水并移入c中,在a中加入15mL20%的NaOH溶液。加热和搅拌装置,然后慢慢滴加氯乙酸和NaOH溶液,滴加完毕后继续搅拌加热半小时。反应结束后,趁热将反应液倒入烧瓶中,加盐酸至pH为1左右,用冰水冷却使晶体析出,抽滤,洗涤,得粗产品。
Ⅱ.提纯
粗产品![]() 滤液
滤液![]() 少量固体析出
少量固体析出![]()
回答下列问题:
(1)d处应接的装置是__。
(2)合成过程中要在不断搅拌下滴加氯乙酸和NaOH溶液的原因是__。
(3)试剂X是__。
(4)趁热过滤除去的杂质的化学式是__。
(5)提纯步骤中,洗涤抽滤得到的晶体应选用的洗涤剂是__。
【答案】球型冷凝管 防止氯乙酸和NaOH浓度过大,副产物增多 浓溴水  冰水
冰水
【解析】
步骤Ⅰ在合成过程中,为了减少副产物的生成,部分NaOH溶液采取滴加方式,滴加完成后,搅拌加热半小时,要防止部分有机产物挥发,因此需要冷凝回流装置;
步骤Ⅱ中,加入乙醇可以除去无机物,得到有机相包括了对氯苯酚,对氯苯氧乙酸等有机物,需要除去对氯苯酚,可使用浓溴水,生成溴代物,在除去。
(1)分析制备装置,c中添加氯乙酸,故d中应有冷凝回流装置,即球形冷凝管。故答案为:球形冷凝管;
(2)氯乙酸和氢氧化钠溶液浓度过高,会导致副产品增多,故在合成过程中要在不断搅拌下滴加氯乙酸和NaOH溶液。故答案为:防止氯乙酸和NaOH浓度过大,副产物增多;
(3)X试剂除去溶解的少量对氯苯酚,故X为浓溴水。故答案为:浓溴水;
(4)X与对氯苯酚发生取代反应,生成沉淀 ,即过滤出的物质。故答案为:
,即过滤出的物质。故答案为: ;
;
(5)对氯苯氧乙酸微溶于水,用水洗涤即可,为了降低溶解,采用冷水洗涤法。故答案为:冰水。


科目:高中化学 来源: 题型:
【题目】t℃时,AgX(X=Cl、Br)的溶度积与c(Ag+)和c(X-)的相互关系如下图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是( )

A. c点可表示AgCl的不饱和溶液
B. b点的AgCl溶液加入AgNO3晶体可以变成a点
C. t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K=10-4
AgBr(s)+Cl-(aq)平衡常数K=10-4
D. t℃时,取a点的AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是 ( )
选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
A | SO2 | sp | 直线形 | 直线形 |
B | H2O | sp2 | 平面三角形 | V形 |
C | NH3 | sp2 | 三角锥形 | 三角锥形 |
D | CH4 | sp3 | 正四面体形 | 正四面体形 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL 0.1mol/L的CH3COOH溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
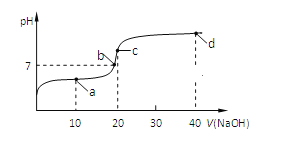
A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+)<c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+)>c(OH-) > c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2二溴乙烷的制备原理是:CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2→ Br2CH2一CH2Br
CH2=CH2+H2O CH2=CH2+Br2→ Br2CH2一CH2Br
某课题小组用下图所示的装置制备1,2-二溴乙烷。

回答下列问题
(1)组装仪器后进行该实验前必须进行的操作是_________。
(2)装置B的作用是_______。
(3)三颈烧瓶内加入一定量的乙醇一浓硫酸混合液和少量粗砂,其加入粗砂目的是_______,仪器E的名称是_________________。
(4)装置C内发生的主要反应的离子方程式为__________________________。
(5)加热三颈烧瓶前,先将C与D连接处断开,再将三颈烧瓶在石棉网上加热,待温度升到约120℃时,连接C与D,并迅速将A内反应温度升温至160-180℃,从滴液漏斗中慢慢滴加乙醇一浓硫酸混合液,保持乙烯气体均匀地通入装有3.20ml液溴(![]() 3g/cm3)和3ml水的D中试管,直至反应结束。
3g/cm3)和3ml水的D中试管,直至反应结束。
①将C与D连接处断开的原因是_____________________,
②判断反应结束的现象是______________________________。
(6)将粗品移入分液漏斗,分别用水、氢氧化钠溶液、水洗涤,产品用无水氯化钙干燥,过滤后蒸馏收集129-133℃馏分,得到7.896g1,2-二溴乙烷。1,2-二溴乙烷的产率为___________。
(7)下列操作中,不会导致产物产率降低的是________ (填正确答案的标号)
a.乙烯通入溴水时速率太快 b.装置E中的NaOH溶液用水代替.
c.去掉装置D烧杯中的水 d.实验时没有C装置 e. D中的试管里不加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.收集氯气可以用排饱和食盐水的方法
B.在一定条件下,氢气与碘蒸汽反应达平衡后,加压,混合气体颜色变深
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是:
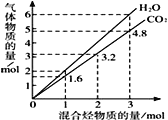
①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷⑤可能有甲烷 ⑥可能有乙炔(C2H2)
A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度一定的条件下,N2(g)+ 3H2(g)![]() 2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为
2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为![]() ,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
A.新的平衡体系中,N2的浓度小于2c mol·L1大于c mol·L1
B.新的平衡体系中,NH3的浓度小于2c mol·L1大于c mol·L1
C.新的平衡体系中,混合体的平均摩尔质量大于![]()
D.新的平衡体系中,气体密度是原平衡体系的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅是单质硅的一种形态,是制造硅抛光片、太阳能电池及高纯硅制晶的主要原料。已知多晶硅第三代工业制取流程如图所示:
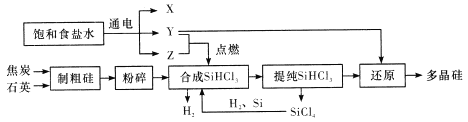
下列说法错误的是
A. Y、Z分别为H2、Cl2
B. 制取粗硅的过程中焦炭与石英会发生副反应生成碳化硅,在该副反应中,氧化剂与还原剂的物质的量之比为1:1
C. SiHCl3极易水解,其完全水解的产物为H2SiO3、H2、HCl,据此推测SiHCl3中硅元素的化合价为+2价
D. Y与SiHCl3制备多晶硅的反应属于置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com