
【题目】根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是 ( )
选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
A | SO2 | sp | 直线形 | 直线形 |
B | H2O | sp2 | 平面三角形 | V形 |
C | NH3 | sp2 | 三角锥形 | 三角锥形 |
D | CH4 | sp3 | 正四面体形 | 正四面体形 |
A.AB.BC.CD.D
【答案】D
【解析】
根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=σ键个数+孤电子对数。
A.SO2分子中心原子S的孤电子对数=![]() ×(6-2×2)=1,价层电子对数=2+1=3,杂化方式sp2杂化,价层电子对互斥模型为平面三角形,去除孤电子对,分子的立体构型为V型结构,A错误;
×(6-2×2)=1,价层电子对数=2+1=3,杂化方式sp2杂化,价层电子对互斥模型为平面三角形,去除孤电子对,分子的立体构型为V型结构,A错误;
B. H2O分子中心原子O的孤电子对数=![]() ×(6-2×1)=2,价层电子对数=2+2=4,杂化方式sp3杂化,价层电子对互斥模型为四面体形,去除孤电子对,分子的立体构型为V型结构,B错误;
×(6-2×1)=2,价层电子对数=2+2=4,杂化方式sp3杂化,价层电子对互斥模型为四面体形,去除孤电子对,分子的立体构型为V型结构,B错误;
C. NH3分子中心原子N的孤电子对数=![]() ×(5-3×1)=1,价层电子对数=3+1=4,杂化方式sp3杂化,价层电子对互斥模型为四面体形,去除孤电子对,分子的立体构型为三角锥形,C错误;
×(5-3×1)=1,价层电子对数=3+1=4,杂化方式sp3杂化,价层电子对互斥模型为四面体形,去除孤电子对,分子的立体构型为三角锥形,C错误;
D.CH4分子中心原子C的孤电子对数=![]() ×(4-4×1)=0,价层电子对数=4+0=4,杂化方式sp3杂化,价层电子对互斥模型为正四面体形,分子的立体构型为正四面体形,D正确。
×(4-4×1)=0,价层电子对数=4+0=4,杂化方式sp3杂化,价层电子对互斥模型为正四面体形,分子的立体构型为正四面体形,D正确。
答案选D。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】已知可逆反应2NO2(g)![]() 2NO(g)+O2(g),在恒压密闭容器中充入NO2,该反应达到化学平衡状态的标志是( )
2NO(g)+O2(g),在恒压密闭容器中充入NO2,该反应达到化学平衡状态的标志是( )
A.反应停止了
B.NO的正反应速率与O2的逆反应速率相等
C.c(NO):c(O2)=2:1
D.混合气体的颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯![]() 作为一种高效强氧化剂,已被联合国世界卫生组织
作为一种高效强氧化剂,已被联合国世界卫生组织![]() 列为AⅠ级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中
列为AⅠ级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中![]() 的质量分数高于
的质量分数高于![]() 等均有可能引起爆炸,易与碱液反应生成盐和水。
等均有可能引起爆炸,易与碱液反应生成盐和水。
![]() 某研究小组设计如图所示实验制备
某研究小组设计如图所示实验制备![]() 溶液,其反应的化学方程式为
溶液,其反应的化学方程式为![]() 。
。
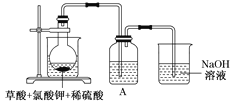
![]() 在反应开始之前将烧杯中的水加热到
在反应开始之前将烧杯中的水加热到![]() ,然后停止加热,并使其温度保持在
,然后停止加热,并使其温度保持在![]() 之间。控制温度的目的是___________,图中装置中缺少的一种必需的玻璃仪器是_______________________。
之间。控制温度的目的是___________,图中装置中缺少的一种必需的玻璃仪器是_______________________。
![]() 装置A用于溶解产生的二氧化氯气体,其中最好盛放________
装置A用于溶解产生的二氧化氯气体,其中最好盛放________![]() 填标号
填标号![]() 。
。
a.20mL60℃的温水 b.100mL冰水 c.100mL饱和食盐水 d.100mL沸水
![]() 在烧瓶中加入12.25gKClO3和9g草酸
在烧瓶中加入12.25gKClO3和9g草酸![]() ,然后再加入足量的稀硫酸,水浴加热,反应后生成
,然后再加入足量的稀硫酸,水浴加热,反应后生成![]() 的质量为________。
的质量为________。
![]() 用
用![]() 处理过的饮用水
处理过的饮用水![]() 为
为![]() 常含有一定量对人体不利的亚氯酸根离子
常含有一定量对人体不利的亚氯酸根离子![]() 。饮用水中
。饮用水中![]() 、
、![]() 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至![]() ;
;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的![]() 溶液滴定至终点;
溶液滴定至终点;
步骤5:再调节溶液的![]() ;
;
步骤6:继续用相同浓度的![]() 溶液滴定至终点。
溶液滴定至终点。
![]() 步骤1中若要量取20.00mL水样,则应选用的仪器是____________________。
步骤1中若要量取20.00mL水样,则应选用的仪器是____________________。
![]() 步骤
步骤![]() 的目的是测定水样中
的目的是测定水样中![]() 的含量,其反应的化学方程式为2ClO2+2KI=2KClO2+I2,2Na2S2O3+I2=Na2S4O6+2NaI,则步骤4中加入的指示剂为______________,滴定达到终点时溶液的颜色变化为______________。
的含量,其反应的化学方程式为2ClO2+2KI=2KClO2+I2,2Na2S2O3+I2=Na2S4O6+2NaI,则步骤4中加入的指示剂为______________,滴定达到终点时溶液的颜色变化为______________。
![]() 步骤5的目的是使
步骤5的目的是使![]() 将溶液中的
将溶液中的![]() 还原为
还原为![]() 以测定其含量,该反应的离子方程式为____________________________。
以测定其含量,该反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水![]() 广泛用作有机反应催化剂。实验室采用镁屑与液溴为原料制备无水
广泛用作有机反应催化剂。实验室采用镁屑与液溴为原料制备无水![]() ,装置如图1,主要步骤如下:
,装置如图1,主要步骤如下:
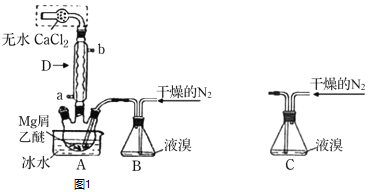
步骤1三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至![]() ,析出晶体,再过滤得三乙醚合溴化镁粗品。
,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4常温下用苯溶解粗品,冷却至![]() ,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至
,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至![]() 分解得无水
分解得无水![]() 产品。
产品。
已知:![]() 和
和![]() 反应剧烈放热;乙醚
反应剧烈放热;乙醚![]() 极易挥发;
极易挥发;
![]() 具有强吸水性。
具有强吸水性。
![]()
![]()
![]()
请回答下列问题:
![]() 仪器D的名称是___________________。冷凝水应该从________
仪器D的名称是___________________。冷凝水应该从________![]() 填a或
填a或![]() 口通入;
口通入;
![]() 干燥的
干燥的![]() 可将液溴吹出,是因为液溴具有___________的性质;实验中不能用干燥空气代替干燥
可将液溴吹出,是因为液溴具有___________的性质;实验中不能用干燥空气代替干燥![]() ,原因是___________;
,原因是___________;
![]() 将装置B改为装置C,可能会导致的后果是_____________________________;
将装置B改为装置C,可能会导致的后果是_____________________________;
![]() 步骤3中,第一次过滤除去的物质是___________________________________;
步骤3中,第一次过滤除去的物质是___________________________________;
![]() 试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水
试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水![]() 产品的原因:__________________________;
产品的原因:__________________________;
![]() 为测定产品的纯度,可用EDTA标准溶液滴定,反应的离子方程式:
为测定产品的纯度,可用EDTA标准溶液滴定,反应的离子方程式:![]() ;测定前,先称取
;测定前,先称取![]() 无水
无水![]() 产品,溶解后,用0.0500mol/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液20.00mL,则测得无水
产品,溶解后,用0.0500mol/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液20.00mL,则测得无水![]() 产品的纯度是_________________
产品的纯度是_________________![]() 以质量分数表示
以质量分数表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组探究足量的镁与浓硫酸反应。回答下列问题:
Ⅰ.甲同学设计如图实验验证该过程产生的混合气体中含有![]() 、
、![]() 。
。
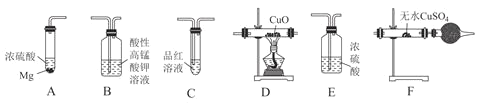
![]() 若按气体从左到右的流向,各装置的连接顺序是________
若按气体从左到右的流向,各装置的连接顺序是________![]() 填字母编号
填字母编号![]() 。
。
![]() 已知装置A中浓硫酸的质量分数为90%,密度ρ=1.47g/mL,该浓硫酸的物质的量浓度为________mol/L。
已知装置A中浓硫酸的质量分数为90%,密度ρ=1.47g/mL,该浓硫酸的物质的量浓度为________mol/L。
![]() 装置C的作用是________。
装置C的作用是________。
![]() 证明混合气体中含有H2的实验现象为________。
证明混合气体中含有H2的实验现象为________。
Ⅱ.乙同学设计如图实验测定混合气体中SO2的含量。

![]() 溶液可以是________
溶液可以是________![]() 填字母
填字母![]() 。
。
![]() 溶液
溶液
![]() 酸性
酸性![]() 溶液
溶液![]() 硫酸酸化
硫酸酸化![]()
![]() 溴水
溴水
![]() 步骤
步骤![]() 中洗涤沉淀的操作为________。
中洗涤沉淀的操作为________。
![]() 通过的混合气体体积为VL(已换算成标准状况)时,该混合气体中二氧化硫的含量
通过的混合气体体积为VL(已换算成标准状况)时,该混合气体中二氧化硫的含量![]() 体积分数
体积分数![]() 为________
为________![]() 用含V、m的代数式表示
用含V、m的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运送“神舟”五号飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子式为_________。
(2)该物质与液态双氧水反应能产生两种无毒又不污染环境的物质,写出该反应的化学方程式_______________________。
(3)NH3分子中的N原子有一对孤对电子 能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的方程式。
能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的方程式。
_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是
A.价电子排布为ns1的元素,不一定是s区元素
B.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5
C.光卤气(COCl2)、甲醛分子的立体构型和键角均相同
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE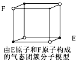
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氯苯氧乙酸是一种具有生长素活性的苯氧类植物生长调节剂。实验室合成原理为:![]() +ClCH2COOH+2NaOH
+ClCH2COOH+2NaOH![]() +NaCl+H2O
+NaCl+H2O
![]() +HCl
+HCl![]() +NaCl
+NaCl
制备过程存在副反应:ClCH2COOH+2NaOH![]() HOCH2COONa+NaCl+H2O
HOCH2COONa+NaCl+H2O
已知相关物质的物理性质:
名称 | 氯乙酸 | 对氯苯酚 | 对氯苯氧乙酸 |
性状 | 无色晶体 | 无色晶体 | 白色晶体 |
水 | 易溶 | 极微溶 | 微溶 |
乙醇 | 易溶 | 溶 | 易溶 |
乙醚 | 易溶 | 溶 | 易溶 |
主要实验装置和步骤如下:
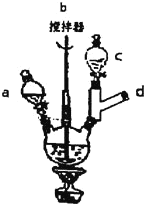
Ⅰ.合成:在三颈烧瓶中加入10mL20%的NaOH溶液、6.4g对氯苯酚和0.5gKI。称取5.3g氯乙酸溶于蒸馏水并移入c中,在a中加入15mL20%的NaOH溶液。加热和搅拌装置,然后慢慢滴加氯乙酸和NaOH溶液,滴加完毕后继续搅拌加热半小时。反应结束后,趁热将反应液倒入烧瓶中,加盐酸至pH为1左右,用冰水冷却使晶体析出,抽滤,洗涤,得粗产品。
Ⅱ.提纯
粗产品![]() 滤液
滤液![]() 少量固体析出
少量固体析出![]()
回答下列问题:
(1)d处应接的装置是__。
(2)合成过程中要在不断搅拌下滴加氯乙酸和NaOH溶液的原因是__。
(3)试剂X是__。
(4)趁热过滤除去的杂质的化学式是__。
(5)提纯步骤中,洗涤抽滤得到的晶体应选用的洗涤剂是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
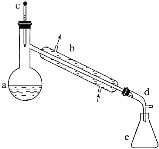
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
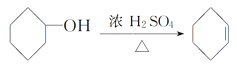 +H2O
+H2O
可能用到的有关数据如下:
相对分子质量 | 密度/ g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是______。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________________。
(4)分液漏斗在使用前须清洗干净并______;在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A 圆底烧瓶 B 温度计 C 吸滤瓶 D 球形冷凝管 E 接收器
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com