
【题目】下列各项叙述中,正确的是
A.价电子排布为ns1的元素,不一定是s区元素
B.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5
C.光卤气(COCl2)、甲醛分子的立体构型和键角均相同
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE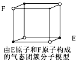
【答案】B
【解析】
A. 价电子排布为ns1的元素,为第IA族元素,一定为s区元素,故A错误;
B. Fe是26元素,其价电子数是8,每个配体CO分子提供电子数为2,则8+2n=18,解得n=5,故B正确;
C. 甲醛分子中碳原子形成了3个σ键,没有孤电子对,因此,碳原子采取sp2杂化,甲醛分子的立体构型为平面三角形,光卤气(COCl2)分子中C原子价层电子对数=3+![]() =3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面三角形,但是甲醛中与C原子连接的为2个H和1个O,光卤气中与C原子连接的为2个Cl和1个O,H和Cl的电负性不同,则键角不相同,故C错误;
=3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面三角形,但是甲醛中与C原子连接的为2个H和1个O,光卤气中与C原子连接的为2个Cl和1个O,H和Cl的电负性不同,则键角不相同,故C错误;
D. 团簇分子中含有4个E,4个F原子,分子式应为E4F4或F4E4,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】液氨与水性质相似,也存在微弱的电离:2NH3![]() NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
A. 液氨的电离平衡 B. 液氨的离子积常数
C. c(NH4+) D. c(NH2—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化阿托醛![]() 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下:
(1)氢化阿托醛被催化氧化后的含氧官能团的名称是____________.
(2)在合成路线上②③的反应类型分别为②_____________③________________.
(3)反应④发生的条件是_____________________.
(4)由![]() 反应的化学方程式为_______________________________
反应的化学方程式为_______________________________
(5)1mol氢化阿托醛最多可和____mol氢气加成,1mol氢化阿托醛发生银镜反应可生成________molAg.
(6)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为________.D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有______种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是 ( )
选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
A | SO2 | sp | 直线形 | 直线形 |
B | H2O | sp2 | 平面三角形 | V形 |
C | NH3 | sp2 | 三角锥形 | 三角锥形 |
D | CH4 | sp3 | 正四面体形 | 正四面体形 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2Cr2O7溶液,发生的两个化学反应为①SO2+2Fe3++2H2O→![]() +2Fe2++W,②
+2Fe2++W,②![]() +aFe2++bH+→Cr3++Fe3++H2O。下列有关说法正确的是
+aFe2++bH+→Cr3++Fe3++H2O。下列有关说法正确的是
A.还原性:Cr3+>SO2B.方程式②中,a=6,b=7
C.![]() 能将Na2SO3氧化成Na2SO4D.方程式①中W为OH
能将Na2SO3氧化成Na2SO4D.方程式①中W为OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL 0.1mol/L的CH3COOH溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
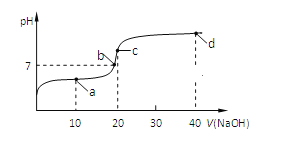
A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+)<c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+)>c(OH-) > c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2二溴乙烷的制备原理是:CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2→ Br2CH2一CH2Br
CH2=CH2+H2O CH2=CH2+Br2→ Br2CH2一CH2Br
某课题小组用下图所示的装置制备1,2-二溴乙烷。

回答下列问题
(1)组装仪器后进行该实验前必须进行的操作是_________。
(2)装置B的作用是_______。
(3)三颈烧瓶内加入一定量的乙醇一浓硫酸混合液和少量粗砂,其加入粗砂目的是_______,仪器E的名称是_________________。
(4)装置C内发生的主要反应的离子方程式为__________________________。
(5)加热三颈烧瓶前,先将C与D连接处断开,再将三颈烧瓶在石棉网上加热,待温度升到约120℃时,连接C与D,并迅速将A内反应温度升温至160-180℃,从滴液漏斗中慢慢滴加乙醇一浓硫酸混合液,保持乙烯气体均匀地通入装有3.20ml液溴(![]() 3g/cm3)和3ml水的D中试管,直至反应结束。
3g/cm3)和3ml水的D中试管,直至反应结束。
①将C与D连接处断开的原因是_____________________,
②判断反应结束的现象是______________________________。
(6)将粗品移入分液漏斗,分别用水、氢氧化钠溶液、水洗涤,产品用无水氯化钙干燥,过滤后蒸馏收集129-133℃馏分,得到7.896g1,2-二溴乙烷。1,2-二溴乙烷的产率为___________。
(7)下列操作中,不会导致产物产率降低的是________ (填正确答案的标号)
a.乙烯通入溴水时速率太快 b.装置E中的NaOH溶液用水代替.
c.去掉装置D烧杯中的水 d.实验时没有C装置 e. D中的试管里不加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是:
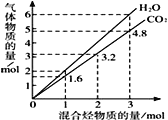
①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷⑤可能有甲烷 ⑥可能有乙炔(C2H2)
A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ____。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn__________g。(已经F=96500C/mol)
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,加碱调节至pH为___________时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_________时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com