
【题目】由醇X制备羧酸Z的合成路线如图所示,不正确的是( )

A. Y的结构有4种
B. X、Z能形成戊酸丁酯,戊酸丁酯最多有16种
C. 与X互为同分异构体,且不能与金属钠反应的有机物有4种
D. 与Z互为同分异构体,且能发生水解反应的有机物有9种
【答案】C
【解析】
A、丁基有四种结构:![]()
![]() ,Y是丁基和溴原子结合而成,所以有四种结构,选项A正确;
,Y是丁基和溴原子结合而成,所以有四种结构,选项A正确;
B、戊酸丁酯中的戊酸,相当于丁基连接一个—COOH,所以有四种结构,而丁醇是丁基连接一个—OH,所以也有四种结构,因此戊酸丁酯最多有16种,选项B正确;
C、X为丁醇,其同分异构体中不能与金属钠反应的是醚,分别是C—O—C—C—C、C—C—O—C—C和![]() 共3种,选项C不正确;
共3种,选项C不正确;
D、Z是戊酸,其同分异构体能发生水解的属于酯类,HCOOC4H9有4种,CH3COOC3H7有2种,CH3CH2COOCH2CH3、CH3CH2CH2COOCH3、(CH3)2CHCOOCH3,所以共9种,选项D正确。
答案选C。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
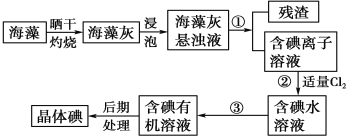
(1)实验室焙烧海带,需要下列仪器中的________(填序号)。
a 试管 b 烧杯 c 坩埚 d 泥三角 e 铁三脚架 f 酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①__________,③________。
(3)提取碘的过程中,可选择的有机试剂是(_______)
A 甲苯、酒精 B 四氯化碳、苯
C 汽油、乙酸 D 汽油、甘油
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有__________、__________。
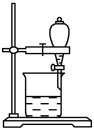
(5)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈__________色;
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
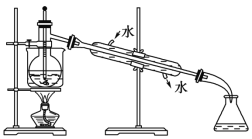
①____________________;
②_______________________________;
③____________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知研究氮及其化合物的转化对于环境改善有重大意义。
I.已知N2(g) +O2(g)=2NO(g) △H=+180.4 kJ/mol,
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H=![]() kJ/mol。
kJ/mol。
(1)用NH3消除NO污染的反应为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H=_______。则该反应自发进行的条件是______________(填“高温”或“低温”)。
5N2(g)+6H2O(l) △H=_______。则该反应自发进行的条件是______________(填“高温”或“低温”)。
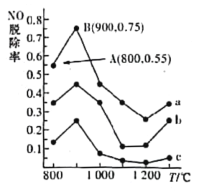
(2)不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。曲线a中NH3的起始浓度为4×10- 5mol/L,从A点到B点经过2秒,该时间段内NO的脱除速率为_______mg/(L·s),在AB所在的曲线上当温度高于900℃时NO脱除率明显降低的原因是_______________________________________________。
Ⅱ.用活性碳还原法也可以处理氮氧化合物,发生的反应为2CO(g)+ 2NO(g)![]() N2(g)+2CO2(g) △H=-746.8kJ/mol。
N2(g)+2CO2(g) △H=-746.8kJ/mol。
(3)在一恒容绝热的密闭容器中,能表示上述反应达到平衡状态的是_____________(填字母代号)。
A.单位时间内断裂1 mol N≡N键的同时生成2 mol C=O键
B.容器内的总压强保持不变
C.混合气体的密度保持不变
D.c(NO):c(N2):c(CO2)=2:1:2
E.混合气体的平均摩尔质量保持不变
(4)向一恒容密闭容器中充入3mol CO和2mol NO,测得气体的总压为10MPa,在一定温度下开始反应,10 min后达到平衡,测得NO的转化率为75%,该反应的平衡常数KP=____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅲ.用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。
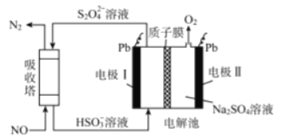
(5)写出吸收塔中的离子反应方程式_____________________________________,反应过程中若通过质子交换膜的H+为1 mol时,吸收塔中生成的气体在标准状况下的体积为_____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)二氯化二硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a.S2Cl2分子中所有原子都满足8电子稳定结构,写出它的电子式____________;
b.指出它分子内的键型_________。
(2)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型储能电池,具有充放电可逆性高、能量转化效率高等优点,其结构如图所示,放电时电极a发生氧化反应。下列说法错误的是
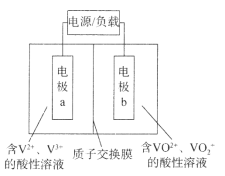
A.充电时电极a应连接电源的负极
B.放电时电极b发生的反应为![]() +e-+2H+=VO2++H2O
+e-+2H+=VO2++H2O
C.放电时电极a附近溶液pH不发生变化
D.充电时H+从质子交换膜右侧向左侧移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量是衡量一个国家石油化工生产水平的重要标志,以A为主要原料合成一种具有果香味的物质E的生产流程如下:
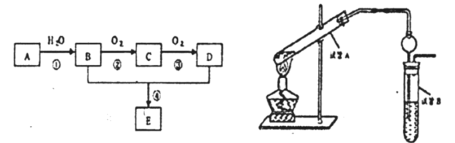
(1)有机物C的名称是_______________
(2)写出B→C的化学方程式________________
(3)请写出B+D→E的化学方程式________________
(4)试管A中加少许碎瓷片的目的是_______________
(5)试管B中试剂的作用是____________________
(6)右边试管接有一个球状物代替了长导管,其作用为______________
(7)从制备乙酸乙酯所得的混合物中分离提纯乙酸乙酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是_____________(填字母)

(8)酯化反应是一一可逆反应, 为提高乙醇的利用率,可采取的措施是_______________。(任写一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某原子结构示意图为 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
A. 结构示意图中x=4
B. 该原子的电子排布式为1s22s22p63s23p4
C. 该原子的电子排布图为![]()
D. 该原子结构中共有5个能级上填充有电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.H2SiO3![]() SiO2
SiO2 ![]() SiCl4
SiCl4
B.Cu![]() Cu(NO3)2(aq)
Cu(NO3)2(aq) ![]() Cu(NO3)2(s)
Cu(NO3)2(s)
C.ClCH2-CH2Cl![]() HOCH2-CH2OH
HOCH2-CH2OH ![]() HOOC-COOH
HOOC-COOH
D.Al![]() Al2O3
Al2O3![]() NaAlO2(aq)
NaAlO2(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com