
【题目】(1)二氯化二硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a.S2Cl2分子中所有原子都满足8电子稳定结构,写出它的电子式____________;
b.指出它分子内的键型_________。
(2)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
【答案】![]() 极性键、非极性键 第四周期第ⅥA AB
极性键、非极性键 第四周期第ⅥA AB
【解析】
根据二氯化二硫分子中所有原子满足8电子进行判断分子的电子式和分子内键型;根据硒的原子结构判断周期数和电子层数;根据元素周期律进行判断。
(1) a.根据二氯化二硫分子中所有原子满足8电子稳定结构,说明硫和硫之间,硫和氯之间均存在一对共同电子对,电子式为:![]() ;
;
b.硫和氯都是非金属元素,分子间存在S—Cl极性键和S—S非极性共价键;
(2) a.硒的原子序数为34,硒在元素周期表中的位置是第四周期第ⅥA;
b.A.铟(In)与铝同族且比铝多两个电子层,镓和铟位于同一主族,同主族元素从上到下原子半径逐渐增大,原子半径:In>Ga,Ga和Se 位于同一周期,Ga在Se的左侧,同周期元素从左到右原子半径逐渐减小,Ga>Se,故原子半径In>Se,故A正确;
B.同主族元素从上到下金属性逐渐增强,金属性:In>Ga,Ga在Se的左侧,同周期元素从左到右金属性减弱,Ga的金属性比Se强,故金属性In>Se,故B正确;
C.铟(In)与铝同族且比铝多两个电子层,同主族元素从上到下金属性增强,In的金属性比Al强,故C错误;
D.硒是第ⅥA族,最低化合价-2价,铟的最高正价为+3价,硒化铟的化学式为In2Se3,故D错误;
答案选AB。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示装置,电流计指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C可能是下列各组中的

A.A是Ag,B是Fe,C为稀AgNO3溶液
B.A是Cu,B是Zn,C为稀H2SO4
C.A是Fe,B是Ag,C为稀AgNO3溶液
D.A是Zn,B是Cu,C为稀H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物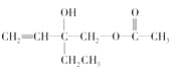 具有手性,发生下列反应后,分子仍有手性的是( )
具有手性,发生下列反应后,分子仍有手性的是( )
①与H2发生加成反应 ②与乙酸发生酯化反应 ③发生水解反应 ④发生消去反应
A. ①② B. ②③ C. ①④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A. 用系统命名法命名有机物A,名称为2,2,3﹣三甲基戊烷
B. 有机物A的一氯取代物只有4种
C. 有机物A的分子式为C8H18
D. B的结构可能有3种,其中一种名称为3,4,4﹣三甲基﹣2﹣戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由醇X制备羧酸Z的合成路线如图所示,不正确的是( )

A. Y的结构有4种
B. X、Z能形成戊酸丁酯,戊酸丁酯最多有16种
C. 与X互为同分异构体,且不能与金属钠反应的有机物有4种
D. 与Z互为同分异构体,且能发生水解反应的有机物有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锂(LiOH)是重要的初加工锂产品之一,可用于继续生产氟化锂、锰酸锂等,在实验室模拟用天然锂辉石(主要成分是LiAlSi2O6)生产LiOH的一种工艺流程如图所示:
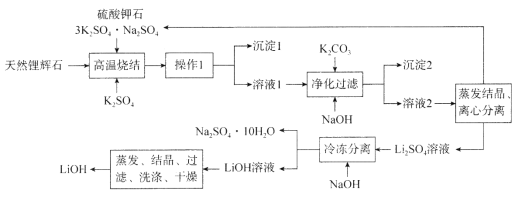
已知:溶液1中含有Li+、K+、Al3+、Na+、Fe3+、![]() 等离子。请回答下列相关问题。
等离子。请回答下列相关问题。
(1)高温烧结的目的是________________________________________________。
(2)操作1是_____________________________。
(3)判断LiOH已洗涤干净的操作是______________________________________________。
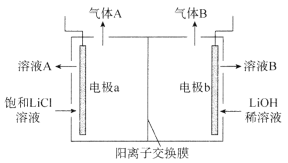
(4)工业生产中通过电解LiC1溶液的方法也可制得LiOH,其原理如图所示,电极a应连接电源的_________(选填“正极”或“负极”),电极b发生的反应是__________,阳离子交换膜的作用是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24 L(标准状况下),则下列情况不可能的是( )
A.加入Cu的质量为6.4 g
B.加入的浓H2SO4中含溶质0.2 mol
C.加入Cu的质量大于6.4 g
D.加入浓H2SO4中含溶质多于0.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com