
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A. 升高温度,可能引起有c向b的变化
B. 该温度下,水的离子积常数为1.0×10-13
C. 该温度下,稀释溶液可能引起由c向d的变化
D. 该温度下,加入FeCl3可能引起由b向a的变化
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+ 、Mg2+ 、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作。其正确的顺序是①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤ 加过量BaCl2 溶液
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质存在如下图所示的转化关系(反应条件、部分产物未标出),已知某物质X是一种正盐,E是强酸
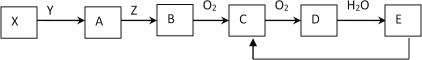
试回答下列问题:
(1)若Y为强酸,且B为黄色固体单质
①从组成物质的元素化合价变化角度预测C可能具有的性质_______________
②一定条件下E转化为C有多种途径,写出其中一种转化的化学反应方程式_______________________。
(2) 若Y为强碱,且B为空气中含量最高的气态单质
①写出实验室制取A的化学方程式______________________________________。
②若A→B的转化常用来检验Z气体管道的是否漏气,用该方法检验的现象是____________________,
其化学反应方程式_________________________________________。
③C、D都是大气污染物,它们对环境造成的危害表现在_______。
A.引起酸雨 B.引起温室效应
C.形成光化学烟雾 D.引起水体富营养化
④将x mL C、y mL D混合于同一试管中,将试管倒置于水中,同时通入z mL O2充分反应后,试管内气体全部消失,则x:y:z不可能是 _______________
A 1:1:1 B 2:1:1
C 3:7:4 D 1:5:2
(3)无论Y为强酸或强碱均符合上述转化,则物质X的化学式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_______。
(2)氯气和FeBr2反应实验操作及现象如下:
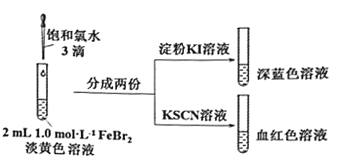
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
(3)丙同学继续设计实验,探究反应过程:
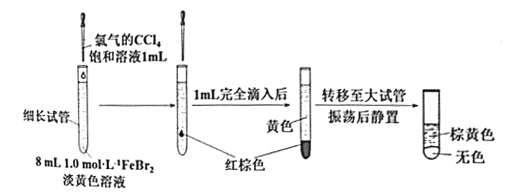
①转移到大试管前CCl4液体中呈红棕色的物质是___________。
②丙通过此实验可得出结论:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).

已知:①物质溶解性:LiF难溶于水,CoCO3难溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)Ⅰ中得到含铝溶液的反应的离子方程式是 。
(2)Ⅰ中得到钴渣的实验操作是 (填操作名称)。
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: .
(4)步骤Ⅲ中调节溶液的pH时, pH的范围是 。
(5)废渣中的主要成分有 .
(6)在空气中加热10.98g草酸钴晶体(CoC2O42H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
温度范围/℃ | 固体质量/g |
150~210 | 8.82 |
290~320 | 4.82 |
890~920 | 4.5 |
②加热到210℃时,固体物质的化学式为: .
③经测定,加热到210~310℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为: ..
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙醇的结构简式为C2H6O
B. 苯酚和乙醇都含有羟基官能团,二者属于同一类物质
C. 实验室制乙酸乙酯用饱和Na2CO3收集
D. 烯烃含有碳碳双键不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常温下的溶液叙述正确的是
A.Mg(OH)2可溶于一定浓度的NH4Cl溶液
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为u和u+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈蓝色
D.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO![]() )>c(NH
)>c(NH![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 实验室制氢气,为了加快反应速率,可向稀硫酸中滴加少量硝酸铜溶液
B. 可用勒夏特列原理解释2NO2(g)![]() N2O4(g)体系加压后颜色变深
N2O4(g)体系加压后颜色变深
C. N2(g)+ 3H2(g)![]() 2NH3(g) ΔH<0可通过加压方式增大其平衡常数
2NH3(g) ΔH<0可通过加压方式增大其平衡常数
D. 二氧化硫和乙烯两种气体分别通入Br2的CCl4溶液,能使溶液褪色的是乙烯气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com