
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。Fe与N相比,第一电离能较大的是_______________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型为_______________和_______________。
)分子中碳原子轨道的杂化类型为_______________和_______________。
(3)C、N、O三种元素形成的氢化物沸点从高到低的顺序为:_____________,原因是________________。
(4)1molN2分子中含有σ键____________mol,含π键______________mol。
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(xn) CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2 所示,其中更稳定的Cu替代型产物的化学式为___________。

【答案】 [Ar]3d5或 1s22s22p63s23p63d5 N sp2 sp3 H2O>NH3>CH4 液态水和液态氨都存在氢键,甲烷没有。O的电负性大于N,水分子中O能形成的氢键数目比液氨中N能形成的氢键数目多。因此H2O>NH3>CH4. 1mol 2mol Fe3CuN
【解析】(1)Fe原子序数为26,Fe3+基态核外电子为23,且3 d电子 为半满稳定结构,可知Fe3+基态核外电子排布式为[Ar]3d5或 1s22s22p63s23p63d5 ,铁的第一电离能是:759.3KJ/mol,N的第一电离能为1400KJ/mol,Fe与N相比,第一电离能较大的是N。
(2)丙酮(![]() )分子中,单键均为σ键,双键中含有1 个σ键,甲基上的C形成4 个σ键,C=O中C形成3 个σ键,均为孤对电子,则羰基上C为sp2杂化,甲基上C为sp3杂化。
)分子中,单键均为σ键,双键中含有1 个σ键,甲基上的C形成4 个σ键,C=O中C形成3 个σ键,均为孤对电子,则羰基上C为sp2杂化,甲基上C为sp3杂化。
(3)C、N、O三种元素氢化物沸点从高到低的顺序为H2O>NH3>CH4,原因是液态水和液态氨都存在氢键,甲烷没有。O的电负性大于N,水分子中O能形成的氢键数目比液氨中N能形成的氢键数目多。因此H2O>NH3>CH4.。
(4)N2分子结构式为N≡N,1molN2分子含有σ键1mol,π键2mol。
(5)由图2 可知,Cu替代a位置的Fe 时能量较低,更稳定,则Cu位于顶点,N(Cu)=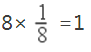 ,Fe位于面心,N(Fe)
,Fe位于面心,N(Fe)![]() ,N位于体心,则只有1 个N,其化学式为:Fe3CuN 。
,N位于体心,则只有1 个N,其化学式为:Fe3CuN 。


科目:高中化学 来源: 题型:
【题目】下列操作或发生事故时的处理方法正确的是( )
A. 可用燃着的酒精灯引燃另一只酒精灯
B. 给试管里的液体加热时,试管应与桌面垂直
C. 配制一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水到刻度线
D. 浓硫酸不慎沾在皮肤上,应立即用大量水冲洗,最后涂上3%~5%的小苏打溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若阿伏加德罗常数的数值用NA表示,下列说法正确的是(相对原子质量:H-1 D-2 He-4 N-14 O-16)
A. 标准状况下,1.12L 氦气所含原子数为0.1NA
B. 22.4 LHCl溶于水,溶液中H+数为NA
C. 1.6gNH2-离子所含电子数为NA
D. 10g D2O所含的中子数为4.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符的是( )

A. 图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
B. 图乙表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C. 图丙表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
D. 图丁表示一定浓度Na2CO3溶液中滴加盐酸,生成CO2与滴加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【衡阳市2017届下学期第三次联考】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A.实验①中,若5min时测得n(M) =0.05mol,则0至5min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B.实验②中,该反应的平衡常数K= 1.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.06
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中用途广泛。利用FeSO4制备还原铁粉的工业流程如下:
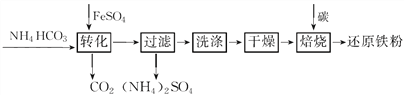
实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节。
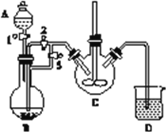
(1)装置A的名称是________,装置B中盛放的试剂是________,NH4HCO3盛放在装置________中。
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合制FeCO3沉淀,操作方法是________________,发生主要反应的离子方程式为_____________________。FeSO4溶液要现用现配制的原因是____________,检验久置的FeSO4是否变质的方法是______________。
(3)干燥过程主要目的是脱去游离水,过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为____________________________,取干燥后的FeCO3样品12.49 g,与碳混合后焙烧,最终得到还原铁粉6.16 g,计算样品中杂质FeOOH的质量:________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于燃烧热的说法中正确的是
A.1 mol物质燃烧所放出的热量
B.常温下,可燃物燃烧放出的热量
C.在25°C、1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量
D.燃烧热随热化学方程式中的化学计量数的改变而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )

A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com