
【题目】某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
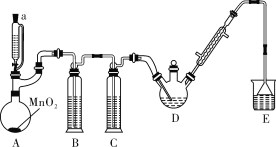
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl,可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
熔点/℃ | —114.1 | —57.5 | 58 | —138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(1)仪器 A 中发生反应的化学方程式是__________;装置B中的试剂是______。
(2)若撤去装置C,可能导致装置D中副产物_________ (填化学式)的量增加;装置D可采用__________加热的方法以控制反应温度在70℃左右。
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH。你认为此方案是否可行,为什么?____________。
(4)装置E中盛有NaOH溶液,写出该装置中所有可能发生的无机反应的离子方程式:_______________。
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol·L一1 碘标准溶液20.00mL,再加入适量 Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L一1Na2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为________。(CCl3CHO的相对分子质量为147.5) 滴定的反应原理:CCl3CHO+OH一 = CHCl3+HCOO一、 HCOO一 +I2 =H+ + 2I- + CO2↑、I2 + 2S2O32一 = 2I- +S4O62一
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 饱和食盐水 CCl3COOH 水浴 不可行,CCl3COOH溶于乙醇与CCl3CHO Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O 88.5%
MnCl2+Cl2↑+2H2O 饱和食盐水 CCl3COOH 水浴 不可行,CCl3COOH溶于乙醇与CCl3CHO Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O 88.5%
【解析】
A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl4CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气;
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水;用饱和食盐水除去HCl;
(2)氯气能与水反应生成HCl与HClO,会发生:CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl、C2H5OH+HCl→C2H5Cl+H2O;控制反应温度在70℃左右,应采取水浴加热;
(3)CCl3COOH溶于乙醇与CCl3CHO;
(4)E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,HCl与氢氧化钠反应生成氯化钠与水;
(5)根据消耗的Na2S2O3计算剩余I2的物质的量,进而计算与HCOO-反应的I2的物质的量,再根据关系式:CCl3CHO~HCOO-~I2计算。
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,B装置用饱和食盐水除去HCl;
MnCl2+Cl2↑+2H2O,B装置用饱和食盐水除去HCl;
故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;饱和食盐水;
MnCl2+Cl2↑+2H2O;饱和食盐水;
(2)氯气能与水反应生成HCl与HClO,会发生:CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl、C2H5OH+HCl→C2H5Cl+H2O,导致装置D中副产物:CCl3COOH、C2H5Cl增多,控制反应温度在70℃左右,应采取水浴加热,受热均匀,偏于控制温度,
故答案为:CCl3COOH;水浴;
(3)CCl3COOH溶于乙醇与CCl3CHO,应采取蒸馏方法进行分离,
故答案为:不可行,CCl3COOH溶于乙醇与CCl3CHO;
(4)E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O;
(5)根据消耗的Na2S2O3计算
剩余I2的物质的量0.02000molL-1×0.02L×![]() =2×10-4mol,与HCOO-反应的I2的物质的量为0.1000molL-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为
=2×10-4mol,与HCOO-反应的I2的物质的量为0.1000molL-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为![]() ×100%=88.5%,
×100%=88.5%,
故答案为:88.5%。


科目:高中化学 来源: 题型:
【题目】硝酸是重要的化工原料,工业上用氨催化氧化法生产硝酸,反应如下:
①氧化炉:4NH3+5O2=4NO+6H2O
②吸收塔:4NO+3O2+2H2O=4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80。完成下列计算:
(1)1mol NH3完全转化为NO至少需要空气______mol。工业上先将氨气和空气混合好,在氧化炉反应后直接通入吸收塔中用冷水吸收,为了确保吸收效果,第②步反应要求氧气至少过量20%,计算起始时空气与氨气的体积比至少为______
(2)硝酸工业产生的氮氧化物尾气(NO和NO2),可用烧碱吸收,反应如下:
①NO+NO2+2NaOH=2NaNO2+H2O
②2NO2+2NaOH=NaNO3+NaNO2+H2O
现有含0.5mol氮氧化物的尾气,用8mol/L的NaOH溶液完全吸收,吸收后的溶液中c(OH﹣):c(NO2﹣):c(NO3﹣)=5:4:1。所用NaOH溶液的体积为______mL。若将尾气中NO与NO2的平均组成记为NOx,则x=______
(3)工业上用硝酸与氨气反应制取硝酸铵:HNO3+NH3=NH4NO3,反应时NH3的吸收率为97%,硝酸的利用率为98%。在用氨气制取硝酸时,氨气的利用率为90%。计算生产80吨的硝酸铵共需氨气__吨?(保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法错误的是( )
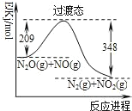
A.使用催化剂可以降低过渡态的能量
B.反应物总能量大于生成物总能量
C.反应的热化学方程式为N2O(g)+NO(g)→N2(g)+NO2(g)+139kJ
D.使用催化剂可提高N2O和NO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
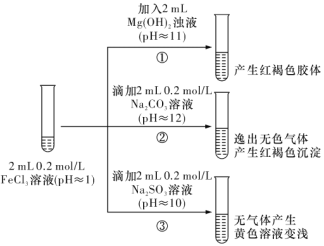
(1)①中反应的离子方程式是__________。
(2)②中逸出的无色气体是____________(写化学式)。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴人稀盐酸酸化,再滴加 BaCl2溶液,产生白色沉淀。得出结论:FeCl3与 Na2SO3 发生了氧化还原反应,离子方程式是_________。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是______。
(4)由上述实验可知,下列说法正确的是___________ (填字母)。
a.盐与碱反应时,盐和碱都必须可溶于水
b.盐溶液可能呈中性、碱性、酸性
c.盐与盐反应时,不一定生成两种新盐
d.盐与盐反应时,发生的不一定是复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g) 达到平衡,正反应速率随时间变化的示意图如下所示,由图可得出的正确结论是
SO3(g)+NO(g) 达到平衡,正反应速率随时间变化的示意图如下所示,由图可得出的正确结论是
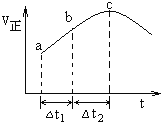
A. 反应在c点达到平衡状态
B. △t1=△t2时,SO2的转化率:a~b段小于b~c段
C. 反应物浓度:a点小于b点
D. 反应物的总能量低于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答以下问题
(1)某温度时,测得pH=11的Ba(OH)2溶液浓度是0.005mol·L-1。
①该温度下水的离子积常数Kw=________。
②在此温度下,将pH=12的Ba(OH)2溶液Va L与pH=2的硫酸Vb L混合。若所得混合液为中性,则Va∶Vb=________。
(2)25 ℃时,部分物质的电离平衡常数如下表所示。请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10—5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①下列说法正确的是__________
A.25 ℃时,向CH3COOH溶液中加入适量的NaOH溶液,CH3COOH的电离程度增大,电离平衡常数不变
B.0.1molL-1 CH3COOH溶液加水稀释,稀释后的溶液中水的电离程度减小
C.0.1molL-1 HClO溶液和0.1molL-1 NaClO溶液等体积混合呈溶液碱性
D.碳酸氢钠溶液中阴阳离子数目相等
② 同浓度的CH3COO-、HCO、CO32-、ClO-结合H+的能力由强到弱的顺序为___
③ 25 ℃时,某CH3COOH和CH3COOK混合溶液呈中性,则该混合溶液中:![]() =________
=________
(3)煤燃烧排放的烟气含有SO2和NO,采用碱性的NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应10min后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式______。
②如果采用Ca(ClO)2替代NaClO2,其脱硫效果会更好。试从化学平衡原理分析,Ca(ClO)2相比NaClO2具有的优点是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cl2通入100mL NaOH溶液中充分反应,生成0.1mol的NaCl,下列说法正确的是( )
A.反应后溶液中ClO﹣的个数为0.1NA
B.原NaOH浓度为1mol/L
C.参加反应的氯气分子为0.1NA
D.转移电子为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com