
����Ŀ����������Ҫ�Ļ���ԭ�ϣ���ҵ���ð����������������ᣬ��Ӧ���£�
������¯��4NH3+5O2=4NO+6H2O
����������4NO+3O2+2H2O=4HNO3
��������������������Ϊ0.20�������������Ϊ0.80��������м��㣺
(1)1mol NH3��ȫת��ΪNO������Ҫ����______mol����ҵ���Ƚ������Ϳ�����Ϻã�������¯��Ӧ��ֱ��ͨ��������������ˮ���գ�Ϊ��ȷ������Ч�����ڢڲ���ӦҪ���������ٹ���20%��������ʼʱ�����백�������������Ϊ______
(2)���Ṥҵ�����ĵ�������β��(NO��NO2)�������ռ����գ���Ӧ���£�
��NO+NO2+2NaOH=2NaNO2+H2O
��2NO2+2NaOH=NaNO3+NaNO2+H2O
���к�0.5mol���������β������8mol/L��NaOH��Һ��ȫ���գ����պ����Һ��c(OH��):c(NO2��)��c(NO3��)=5:4:1������NaOH��Һ�����Ϊ______mL������β����NO��NO2��ƽ����ɼ�ΪNOx����x=______
(3)��ҵ���������백����Ӧ��ȡ����泥�HNO3+NH3=NH4NO3����ӦʱNH3��������Ϊ97%�������������Ϊ98%�����ð�����ȡ����ʱ��������������Ϊ90%����������80�ֵ�����粒��谱��__�֣�(����1λС��)
���𰸡�6.25 10.75 125 1.7 36.8
��������
(1)��4NH3+5O2��4NO+6H2O����֪1mol NH3��ȫת��ΪNO��Ҫ�������ʵ���Ϊ1mol��![]() =1.25mol����������������Ϊ0.2����Ҫ�����������ʵ���Ϊ1.25mol��0.2=6.25mol��
=1.25mol����������������Ϊ0.2����Ҫ�����������ʵ���Ϊ1.25mol��0.2=6.25mol��
��Nԭ���غ��֪1mol�����õ�NOΪ1mol����4NO+3O2+2H2O��4HNO3��֪���ڶ�����Ӧ����������Ϊ1mol��![]() =0.75mol�����һ����Ӧ��ʣ���������ʵ���0.75mol��(1+20%)=0.9mol������Ҫ���������Ϊ(1.25mol+0.9mol)=2.15mol������Ҫ�������ʵ���Ϊ2.15mol��0.2=10.75mol������ʼʱ�����백�������������Ϊ10.75mol��1mol=10.75��
=0.75mol�����һ����Ӧ��ʣ���������ʵ���0.75mol��(1+20%)=0.9mol������Ҫ���������Ϊ(1.25mol+0.9mol)=2.15mol������Ҫ�������ʵ���Ϊ2.15mol��0.2=10.75mol������ʼʱ�����백�������������Ϊ10.75mol��1mol=10.75��
(2)��Ӧ����Һ��c(OH-)��c(NO2-)��c(NO3-)=5��4��1����Nԭ���غ��֪��n(NaNO2)=0.5mol��![]() =0.4mol��n(NaNO3)=0.5mol��
=0.4mol��n(NaNO3)=0.5mol��![]() =0.1mol����n��(NaOH)=5n(NaNO3)=0.5mol�������������غ��֪n��(NaOH)=n��(NaOH)+n(NaNO3)+n(NaNO2)=0.5mol+0.1mol+0.4mol=1mol����NaOH��Һ���Ϊ
=0.1mol����n��(NaOH)=5n(NaNO3)=0.5mol�������������غ��֪n��(NaOH)=n��(NaOH)+n(NaNO3)+n(NaNO2)=0.5mol+0.1mol+0.4mol=1mol����NaOH��Һ���Ϊ![]() =0.125L����Ϊ125mL��
=0.125L����Ϊ125mL��
���ݷ���ʽ2NO2+2NaOH=NaNO2+NaNO3+H2O��֪����0.1mol NaNO3��Ҫ0.2mol NO2��ͬʱ����0.1mol NaNO2�����ݷ���ʽNO+NO2+2NaOH=2NaNO2+H2O��֪����0.4mol-0.1mol=0.3mol NaNO2��Ҫ0.15molNO��0.15mol NO2����NOΪ0.15mol��NO2Ϊ0.35mol��
��������N��Oԭ����Ŀ֮��Ϊ0.5mol��(0.15mol+0.35mol��2)=1��1.7����x=1.7��
(3)���������а�����2�������ã�һ���Ʊ����ᣬ��NԪ���غ�ɵù�ϵʽNH3��HNO3�����������ᷴӦ�õ�NH4NO3���ɷ���ʽ��֪ʵ�����õİ������������ʵ�����ȣ���������֮��Ϊ17��63��
����80�ֵ������ʱ���μӷ�Ӧ����Ϊ80����![]() =17�֣���Ҫ����Ϊ80��-17��=63�֣�
=17�֣���Ҫ����Ϊ80��-17��=63�֣�
�ϳ�NH4NO3ʱNH3��������Ϊ97%����Ͷ��İ���17����97%=17.53�֣�
��ϳ�������Ҫ����Ϊm����
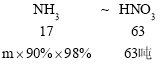
����17��63=m��90%��98%��63�֣����m=19.27�֣�����Ҫ����������Ϊ17.53��+19.27��=36.8�֡�


 ���ƿ�����ϵ�д�
���ƿ�����ϵ�д� ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�����ʾ��ȷ����
��CSO�ĵ���ʽ��![]()
�ڶ��������ӵĽṹ��ʽ��![]()
��Cl���Ľṹʾ��ͼ��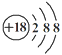
�ܱ����ӵı���ģ�ͣ�
�������ǵ�ʵ��ʽ��CH2O
��ԭ�Ӻ�����20�����ӵ���ԭ�ӣ�![]()
��HCO3����ˮ�ⷽ��ʽΪ��HCO3����H2O![]() CO32����H3O��
CO32����H3O��
A.�٢ܢ�B.�٢ڢۢܢ�C.�ۢݢޢ�D.ȫ����ȷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������6.4g����������ȫȼ�գ�ֻ����8.8gCO2��7.2gH2O������˵����ȷ���ǣ� ��
A.�û��������̼��������Ԫ��
B.�û�������̼����ԭ�Ӹ�����Ϊ1��8
C.��ȷ���û������Ƿ�����Ԫ��
D.�û�������һ��������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������Ļ������0.1mol������ַ�Ӧ��ͨ��60mL 2mol/L��NaOH��Һ�У�������Һ��ֻ����2�����ʣ�����NaClΪ0.1mol����ԭ������������������ʵ���������(����)
A.0.03molB.0.04molC.0.05molD.0.06mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ(1)��ͼ(2)��A��B�������ʵĺ˴Ź������ס���֪A��B�������ʶ������࣬������6����ԭ�ӡ������ͼ(1)��ͼ(2)�������ʵĺ˴Ź�������ͼѡ�����������ͼ(1)��ͼ(2)����������(����)

A. A��C3H6��B��C6H6
B. A��C2H6��B��C3H6
C. A��C2H6��B��C6H6
D. A��C3H6��B��C2H6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������������(����)
A. 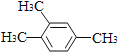 1��2��4-���ױ�
1��2��4-���ױ�
B. ![]() 3-��-1-��ϩ
3-��-1-��ϩ
C. ![]() 2-��-1-����
2-��-1-����
D. ![]() 1��3-�������
1��3-�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������Ա�������Ni / Al2O3 Ϊ��������CO2��H2ת��Ϊ��ƷCH4�ķ�Ӧ���̣���ʾ��ͼ���£�

����˵������ȷ����
A. �ܷ�Ӧ����ʽΪ��CO2+4H2![]() CH4+2H2O
CH4+2H2O
B. ��������Ч��߷�Ӧ���ƽ��ת����
C. �ڷ�Ӧ�����У�H�DH����C=O��������������
D. ��Ӧ�����У��������뷴Ӧ���ı䷴Ӧ·�������ͷ�Ӧ�Ļ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ�Ļ�������ԭ�ϡ�����ϩ�ϳɹ�ѧ��֬CR-39����Ĺ������£�
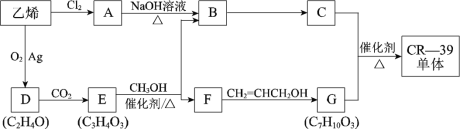
��֪��i��CR-39����ṹ��ʽ�ǣ�
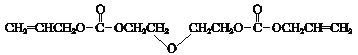
ii�����봼�����·�Ӧ��![]()
(1)��ϩת��ΪA�ķ�Ӧ������___________��
(2)��D��E�ķ����У���ֻ��һ�ֻ�ѧ��������ԭ�ӡ� D�Ľṹ��ʽ��__________��EΪ��Ԫ��״�����E��CH3OH��Ӧ�Ļ�ѧ����ʽ��_____________��
(3)G������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��________________��
(4)F��һ��ͬ���칹��K��������в�ͬ��ѧ��������ԭ�Ӹ�������3��1��1��1��������NaHCO3��Ӧ��
��K�ܷ�����ȥ��Ӧ�����ɵ��л���Ľṹ��ʽ��______________ ��
��K��һ�������ºϳɸ߷��ӻ�����Ļ�ѧ����ʽ��_______________��
(5)�����й�C��������ȷ����(��д���)_______��
a. �������ᷢ��������Ӧ b. �����Ҵ�����������Ӧ
c. 1 mol C�������2 mol Na��Ӧ d. C��ͬ���칹�岻�ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij̽��С�������ͼ��ʾװ��(�г֡�����������)��ģ�ҵ���������Ʊ�������ȩ(CCl3CHO)��ʵ�顣�������ϣ��й���Ϣ���£�
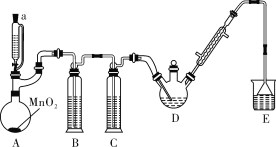
���Ʊ���Ӧԭ����C2H5OH+4Cl2��CCl3CHO+5HCl�����ܷ����ĸ���Ӧ��C2H5OH+HCl��C2H5Cl+H2O��CCl3CHO+HClO��CCl3COOH(��������)+HCl
��������ʵIJ����������ʣ�
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
�۵㣯�� | ��114.1 | ��57.5 | 58 | ��138.7 |
�е㣯�� | 78.3 | 97.8 | 198 | 12.3 |
�ܽ��� | ��ˮ���� | ������ˮ���Ҵ� | ������ˮ���Ҵ� | ����ˮ���������Ҵ� |
(1)���� A �з�����Ӧ�Ļ�ѧ����ʽ��__________��װ��B�е��Լ���______��
(2)����ȥװ��C�����ܵ���װ��D�и�����_________ (�ѧʽ)�������ӣ�װ��D�ɲ���__________���ȵķ����Կ��Ʒ�Ӧ�¶���70�����ҡ�
(3)��Ӧ��������������Ƚ�D�еĻ������ȴ�����£����ù��˵ķ��������CCl3COOH������Ϊ�˷����Ƿ���У�Ϊʲô��____________��
(4)װ��E��ʢ��NaOH��Һ��д����װ�������п��ܷ���������Ӧ�����ӷ���ʽ��_______________��
(5)�ⶨ��Ʒ���ȣ���ȡ��Ʒ0.30g��ɴ�����Һ������0.1000mol��Lһ1 �����Һ20.00mL���ټ������� Na2CO3��Һ����Ӧ��ȫ�����������Һ��pH��������0.02000mol��Lһ1Na2S2O3��Һ�ζ����յ㡣����ƽ��ʵ��������Na2S2O3��Һ20.00mL�����Ʒ�Ĵ���Ϊ________��(CCl3CHO����Է�������Ϊ147.5) �ζ��ķ�Ӧԭ����CCl3CHO+OHһ = CHCl3+HCOOһ�� HCOOһ +I2 =H+ + 2I- + CO2����I2 + 2S2O32һ = 2I- +S4O62һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com