
【题目】A、B、C、X是中学化学中常见的4种物质,它们均由短周期元素组成,转化关系如图所示。请针对以下三种情况回答下列问题。

(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得白色胶状沉淀B。
①A中含有的金属元素为__________(填元素名称)
② 该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,反应的化学反应方程式是_______________
(2)若A为固态非金属单质,A与X同周期,常温常压下C 为 白色固体,B分子中各原子最外层均为8电子结构。
① B的电子式为_____________。
② C与水剧烈反应,生成两种常见酸,反应的化学方程式为___________________。
(3) 若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
① A中所含有的化学键是_____________。
② 自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________g。
【答案】铝 2Al+Fe2O3= 2Fe+Al2O3 ![]() PCl5+4H2O=H3PO4+5HCl 离子键和共价键 2.65
PCl5+4H2O=H3PO4+5HCl 离子键和共价键 2.65
【解析】
A、B、C、X是中学化学常见物质,均由短周期元素组成。
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,X为氢氧化钠;
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构,由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,X为氯气;
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,X为二氧化碳,然后结合物质的性质及化学用语来解答。
A、B、C、X是中学化学常见物质,均由短周期元素组成,则
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,X为氢氧化钠,
①由上述分析可知A、B、C中含有的同一种常见金属元素为Al,名称为铝,故答案为:铝。
②Al与氧化铁发生铝热反应可用于焊接铁轨及定向爆破,此反应的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3![]() Al2O3+2Fe。
Al2O3+2Fe。
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构,由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,X为氯气;
①B为三氯化磷,各原子都大8电子稳定结构,三氯化磷B的电子式为![]() ;
;
故答案为:![]() 。
。
②C为五氯化磷,与水剧烈反应,生成磷酸和盐酸,反应的化学方程式为PCl5+4H2O=H3PO4+5HC1;
故答案为:PCl5+4H2O=H3PO4+5HC1。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,X为二氧化碳,
①A为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,属于A中所含有的化学键是离子键、共价键,故答案为:离子键;共价键。
②自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为1/2×0.1L×0.5mol/L×106g/mol=2.65g,
故答案为:2.65g。


科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应N2+3H2![]() 2NH3 △H<0达到平衡后,只改变一个条件,下列叙述错误的是
2NH3 △H<0达到平衡后,只改变一个条件,下列叙述错误的是
A. 加催化剂,v正、v逆都发生变化,且变化的倍数相等
B. 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C. 增大氮气的浓度,N2的平衡转化率减小,H2的平衡转化率增大
D. 降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是
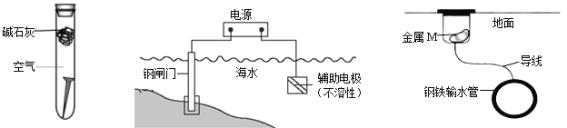
图① 图② 图③
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若断开电源,钢闸门将发生吸氧腐蚀
C. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)某温度下,气体X和Y在体积为2L的密闭容器中反应,生成气体Z。经测定各物质的物质的量随时间变化如下图所示,经10s达到化学平衡状态,请回答下列问题。
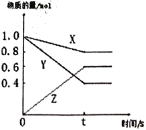
(1)写出该反应的化学反应方程式____________________________________。
(2)该温度下此反应的平衡常数______________________。
(Ⅱ).已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0请回答下列问题:
P(g)+Q(g) ΔH>0请回答下列问题:
(3)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为___________;
(4)若反应温度升高,M的转化率_______(填“增大”“减小”或“不变”) ;
(5)若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=_________;
(6)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中硫酸只表现出氧化性的是
A.实验室用浓硫酸干燥氯气、氯化氢等气体
B.将单质碳与浓硫酸混合加热、有刺激性气味气体产生
C.浓硫酸与铜反应,会生成硫酸铜
D.用浓硫酸在木制品上“烙”字画
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.常温下,浓硫酸不与铜反应,是因为铜被钝化
B.可用铁罐来进行储存、运输冷的浓硫酸
C.SO3具有氧化性,SO2只有还原性
D.SO2、Cl2的漂白原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si三种成分)进行分离、回收再利用的工业流程,通过该流程能得到常用的单质、聚铁(碱式硫酸铁的聚合物)、铁红(Fe2O3)和绿矾(FeSO4·7H2O)。
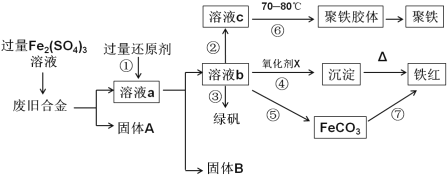
(1)①中过量的还原剂应是____________________。
(2) 向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_______________________。
(3)②中加入H2O2,并调节pH值得到溶液c,在⑥中,将溶液c控制到70-80℃的目的是________。
(4)在③中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有_________________________。
(5)在④中的氧化剂X是________________________。
(6)在⑤中,向溶液b加入了NH4HCO3溶液,得到FeCO3沉淀,写出离子反应方程式 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定试样Fe2O3、Cu、Fe混合物中铜的质量分数,某同学取质量为ag的试样进行下列实验,所得气体数据在标准状况下测得,所涉及的过程如下:

注:已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Cu2+ |
开始沉淀PH | 2.5 | 7.0 | 4.7 |
完全沉淀PH | 3.7 | 9.0 | 6.7 |
下列说法不正确的是
A. 气体B为氢气
B. 溶液A中所含的阳离子可能是H+ 、 Fe3+ 、 Fe2+、 Cu2+
C. 加入过氧化氢溶液时发生的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D. 若沉淀E经洗涤、烘干、灼烧后得到固体mg,则试样中Cu的质量分数=(a-0.56)/a×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究浓硫酸和二氧化硫的性质,设计了如下图所示的装置进行实验(夹持装置已省略):

请回答:
(1)用“可抽动铜丝”代替“直接投入铜片”的优点是_____。
(2)说明SO2气体产生的实验现象是_____。装置⑤的作用是_____。
(3)为了验证SO2是酸性氧化物,③中可选择的试剂是_____。
A.澄清石灰水 B.饱和食盐水 C.碘水 D.品红溶液
(4)下列说法正确的是_____。
A.实验开始后,②和④中溶液均褪色,两者均可证明SO2具有漂白性
B.反应后,将①试管中的白色固体加入水中,溶液呈蓝色
C.先向装置中加入试剂(药品),再进行气密性检查
D.⑤中的NaOH溶液可用Na2CO3溶液代替
(5)若将抽动的铜丝换成炭块进行反应,写出反应的化学方程式_____;该反应体现浓硫酸的_____(选填“脱水性”“吸水性”“强氧化性”“酸性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com