
【题目】草酸(H2C2O4,二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用。
(1)硫酸酸化的KMnO4能与Na2C2O4溶液反应生成Mn2+和CO2,该反应的离子方程式为__________;
(2)分别使10 mL pH=3的H2C2O4溶液和100 mL pH=4的H2C2O4溶液全部转化为Na2C2O4,所需等浓度的NaOH溶液的体积为V1和V2,则V1_____V2(填“>”“<”或“=”)
(3)常温下,用0.1000 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图,c点所示溶液中:![]()
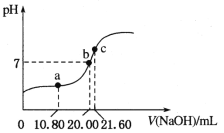
①该草酸溶液的物质的量浓度为__________;
②a点所示溶液中各离子的浓度由大到小的顺序为_________________;
(4)已知:某温度时,Ksp(FeC2O4)=2.0×10-7,Ksp(CaC2O4)=2.5×10-9。
①此温度下,CaC2O4饱和溶液的物质的量浓度为________;
②此温度下,向Na2C2O4溶液中加入FeCl2与CaCl2,当两种沉淀共存时,溶液中c(Fe2+):c(Ca2+)=_____。
【答案】2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O > 0.054 mol/L c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) 5×10-5 mol/L 80
【解析】
(1)根据KMnO4能与热的经硫酸化的Na2C2O4反应生成Mn2+和CO2,并利用质量守恒定律、电荷守恒、电子守恒来书写离子反应方程式;
(2)相同温度下,酸的浓度越小其电离程度越大,草酸和碱反应消耗碱的物质的量与酸的物质的量成正比;
(3)①用0.1000 mol/LNaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,根据c点离子浓度之间的关系,得到c点的溶液是草酸钠的水溶液,根据滴定原理来计算;
②a点所示溶液显示酸性,此时得到的是草酸氢钠溶液,据此回答;
(5)①根据Ksp的意义结合物质的量浓度公式c=![]() 来计算;
来计算;
②根据Ksp表达式得到溶液中c(Fe2+):c(Ca2+)等于Ksp(FeC2O4):Ksp(CaC2O4),据此计算。
由KMnO4能与热的经硫酸化的Na2C2O4反应生成MnSO4和CO2,反应的化学方程式为2KMnO4+5Na2C2O4+8H2SO4=K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,根据物质拆分原则,其离子方程式是:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O;
(2)相同温度下,酸的浓度越小其电离程度越大,所以pH=3草酸的浓度大于pH=4草酸浓度的10倍,10 mLpH=3的草酸溶液和100 mLpH=4的草酸溶液,前者的物质的量大于后者,草酸和碱反应消耗碱的物质的量与酸的物质的量成正比,所以消耗氢氧化钠体积V1>V2;
(3)①用0.100 mol/LNaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,根据c点离子浓度之间的关系,得到c点的溶液是草酸钠的水溶液,草酸和氢氧化钠之间按照1:2物质的量之比进行反应,所以该草酸溶液的物质的量浓度c(H2C2O4)=![]() ≈0.054 mol/L;
≈0.054 mol/L;
②c点为Na2C2O4溶液,此时NaOH溶液的体积是21.60 mL,而a点时NaOH溶液的体积是10.80 mL,恰好是c点消耗的一半,则a点溶液为NaHC2O4溶液;所示溶液显示酸性,说明HC2O4-电离程度大于其水解程度,且溶液中同时存在水电离产生H+,且HC2O4-电离程度远大于水的电离程度,则c(H+)>c(C2O42-)>c(OH-);HC2O4-由于电离、水解消耗,而溶液中Na+不发生任何变化,盐电离产生的离子浓度远大于其电离产生的微粒浓度,所以c(Na+)>c(HC2O4-)>c(H+),故溶液中各离子的浓度由大到小的顺序为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(4)①已知Ksp(CaC2O4)=2.5×10-9,假设饱和溶液浓度是x,则根据溶度积常数的含义可知Ksp=c(Ca2+)c(C2O42-)=x2=2.5×10-9=25×10-10,所以x=5×10-5 mol/L,溶液的体积是1 L,所溶解的草酸钙的物质的量是5×10-5mol;
②此温度下,向Na2C2O4溶液中加入FeCl2与CaCl2,当两种沉淀共存时,溶液c(Fe2+):c(Ca2+)等于Ksp(FeC2O4):Ksp(CaC2O4)=![]() =80。
=80。


科目:高中化学 来源: 题型:
【题目】二硫化钨(WS2,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备二硫化钨的工艺流程如下:
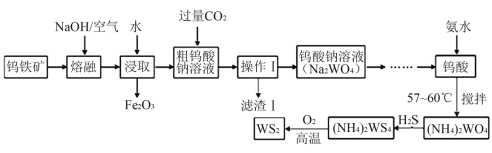
请回答下列问题:
(1)“滤渣Ⅰ”的化学式为__________;
(2)提高“熔融”速率的措施有_____________________(写一条即可);
(3)用离子方程式表示通入过量CO2的主要目的是:________________________;
(4)钨酸与氨水反应时控制温度为58℃,温度不宜太高,其原因是___________。
(5)已知2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O,若该反应转移了8 mol电子,则生成的气体产物在标准状况下的体积为______L;
2WS2+4NH3+2S+2SO2+2H2O,若该反应转移了8 mol电子,则生成的气体产物在标准状况下的体积为______L;
(6)常温下,Ksp(CaWO4) =1×10-10。在钨酸钠溶液中滴加澄清石灰水产生钨酸钙沉淀,当溶液中pCa=-1g c(Ca2+)=4,c(WO42-)=_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
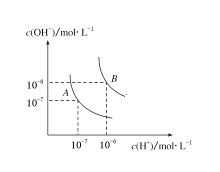
①如果加入蒸馏水,应加_________mL;
②如果加入pH=10的NaOH溶液,应加_________mL;
(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、 “抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_________。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中山大学中山医学院颜光美教授课题组发现一种叫![]() 的天然病毒(属于蛋白质),其能杀死癌细胞而不伤害正常细胞,该病毒含有C、H、O、N、S等元素,其直径大约为
的天然病毒(属于蛋白质),其能杀死癌细胞而不伤害正常细胞,该病毒含有C、H、O、N、S等元素,其直径大约为![]() 。下列说法不正确的是( )。
。下列说法不正确的是( )。
A.![]() 病毒中的C、H、O、N、S原子最有可能以共价键结合
病毒中的C、H、O、N、S原子最有可能以共价键结合
B.![]() 病毒不属于高分子化合物
病毒不属于高分子化合物
C.![]() 病毒溶于水形成的液体具有丁达尔效应
病毒溶于水形成的液体具有丁达尔效应
D.![]() 病毒在生物体内的水解产物可能是氨基酸
病毒在生物体内的水解产物可能是氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3。回答下列问题
①CO![]() 移向____________极。
移向____________极。
②正极反应式为____________________。
③电池中CO![]() 的物质的量将逐渐________________(填增大、减少、不变)。
的物质的量将逐渐________________(填增大、减少、不变)。
(2)用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则
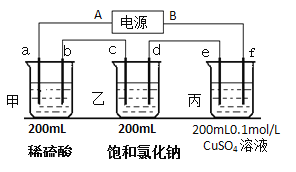
①电源A极是______________极。
②c极上的电极反应式:___________________。
③甲、乙两池共可收集到________mol气体。
④丙装置上某极可析出固体________克,溶液的pH为________________。(常温,不考虑溶液体积变化)
⑤电解n分钟后,硫酸铜正好消耗完,再将e、f电极反接电源,用同样的电流再电解n分钟,则丙溶液中的硫酸铜的物质的量浓度为______________mol/L。(不考虑溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:X(s)+Y(g)![]() 2Z(g)在容积为1L密闭容器反应,下列叙述不是反应达到平衡状态的标志的是
2Z(g)在容积为1L密闭容器反应,下列叙述不是反应达到平衡状态的标志的是
①单位时间内生成1molX的同时消耗2molZ ②Z的体积分数不再变化
③体系的压强不再改变 ④Y、Z的物质的量浓度比为1:2
⑤Y的转化率不再改变的状态 ⑥混合气体的密度不再改变的状态
A. 仅①④ B. ①③④ C. ①④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰广泛应用于医药、食品、农药、造纸等行业,如图是以软锰矿(主要成分是MnO2,还含有SiO2等杂质)和黄铁矿(FeS2)制取MnSO4H2O的流程图,已知Ksp(MnCO3)=2.2×10-11,气体![]() 常用作气体肥料。回答下列问题:
常用作气体肥料。回答下列问题:
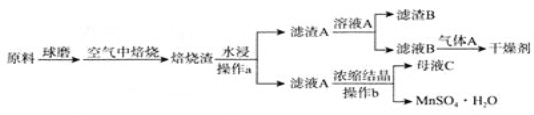
(1)空气中高温焙烧发生反应的化学方程式为________.
(2)气体![]() 的电子式为________。
的电子式为________。
(3)操作a所用的主要玻璃仪器:________。
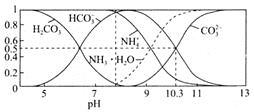
(4)常温下,0.1mol/L碳酸氢铵溶液中微粒浓度分数与pH的关系如图所示,取一定量母液C加入NH4HCO3至其浓度为0.1mol/L可制得高性能强磁性材料MnCO3,该反应的离子方程式为________![]() 同时调pH=10.3,则溶液中c(Mn2+)=________.
同时调pH=10.3,则溶液中c(Mn2+)=________.
(5)硫酸锰是工业制备MnO2电极的活性原料,则用惰性电极电解酸性母液C制得MnO2的阳极电极反应式为________![]() 若电路中通过0.3mol电子时,理论上得到MnO2的质量为________g。
若电路中通过0.3mol电子时,理论上得到MnO2的质量为________g。
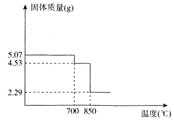
(6)如图是MnSO4H2O的热重曲线,则850℃时固体化学式为________.700℃时发生反应的化学方程式是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组性质比较中,正确的是()
①沸点:![]()
②离子还原性:![]()
③酸性:![]()
④金属性:![]()
⑤气态氢化物稳定性:![]()
⑥半径:![]()
A.①②③B.③④⑤⑥C.②③④D.①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是元素周期表中前四周期的元素,它们的原子序数依次增大。A是宇宙中含量最丰富的元素,B、D原子的L层有2个未成对电子。E3+离子M层3d轨道电子为半满状态,F比E原子序数大1且位于同一族,G的最外层只有1个电子。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出E的电子排布式____________,E位于周期表____区。
(2)B、C、D的第一电离能由小到大的顺序为___________。
(3)A、B、D三种元素可以形成组成为A2BD、A4BD、A2BD2的分子,其中B原子采取sp3 杂化的是_________(填结构简式)
(4)![]() 的空间构型为___________,键角为_______。
的空间构型为___________,键角为_______。
(5)F可形成分子式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4往其溶液中加BaCl2溶液时,现象是_______;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时产生淡黄色沉淀,则第二种配合物的化学式为_______
(6)B元素在自然界有多种同素异形体,硬度最大晶体中每个晶胞中平均含有___个B原子。若晶胞的棱长为acm,则它的密度为____g/cm3(NA表示阿伏加德罗常数)
(7)G的一种氧化物M的晶胞结构如图所示(小圆圈代表氧原子),则M的化学式为________,该晶体中氧原子的配位数为_______。
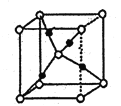
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com