
【题目】已知断开1molH-H键吸收的能量为436KJ,形成1molH-N键放出的能量为391KJ,根据化学方程式N2+3H2![]() 2NH3,反应完1molN2放出的能量为924KJ,则断开1molN≡N键吸收的能量是
2NH3,反应完1molN2放出的能量为924KJ,则断开1molN≡N键吸收的能量是
A.431KJ B.649KJ C.869KJ D.945.6KJ
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中位置如图所示,已知W原子的最外层电子数比内层电子数少3个,下列说法正确的是( )
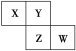
A. W的氧化物对应的水化物是强酸B. 原子半径:X﹥Y
C. Z单质氧化性强于Y单质D. X的氢化物的水溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等体积的0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液混合得到浊液,过滤后进行如下实验:
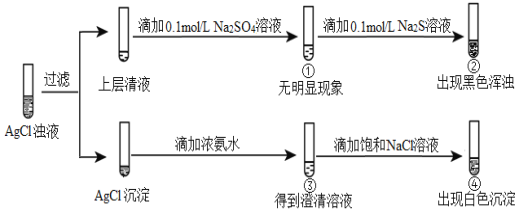
下列分析不正确的是
A. ①的现象说明上层清液中不含Ag+
B. ②的现象说明该温度下Ag2S比Ag2SO4更难溶
C. ③中生成Ag(NH3)2+,促进AgCl(s)溶解平衡正向移动
D. 若向③中滴加一定量的硝酸,也可以出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As的原子结构示意图为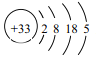 ,则其在周期表中的位置是______________________。
,则其在周期表中的位置是______________________。
(2)N元素非金属性比As强,下列说法正确的是___________________________。
①NH3的热稳定性比AsH3差 ②HNO3的酸性比H3AsO4强 ③N的原子半径比As的原子半径小
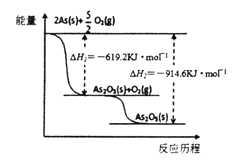
(3)根据下图写出As2O5分解为As2O3的热化学方程式______________________________________。
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:

①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应________(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的系列操作包括________________________________________。
③写出过程Ⅲ的离子方程式_________________________________,过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2→4LiCl+S+SO2,下列有关判断正确的是(提示:SOCl2中S显![]() 价)
价)
A. 还原剂只有Li
B. SOCl2既是氧化剂又是还原剂
C. 还原产物包括LiCl和S
D. 生成1.12LSO2时,反应转移电子为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是
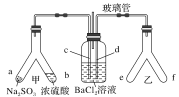
A. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
B. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
C. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
D. e、f两管中的试剂可以分别是浓氨水和NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3===FeCO3↓+Na2SO4 FeCO3 +C6H8O7=FeC6H6O7+CO2↑+H2O
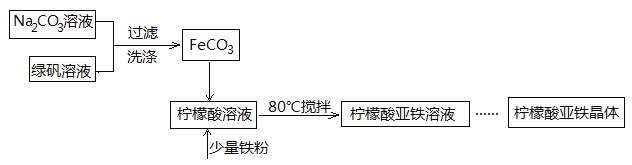
(1)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
(2)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。
①铁粉的作用是_________________。
②反应结束后,无需过滤,除去过量铁粉的方法是_____________。
(3)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是________________。
(4)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):
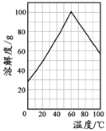
①向一定量烧渣中加入足量的稀硫酸充分反应,过滤
②向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体
③向固体中加入足量稀硫酸至固体完全溶解
④再加入足量的铁粉,充分搅拌后,过滤得到FeSO4 溶液
⑤_______________________________________________,得到FeSO4·7H2O 晶体。
(5)取25.00g柠檬酸亚铁晶体(摩尔质量为246g/mol),配成100mL溶液,取20.00mL至锥形瓶中,另取0.2000mol.L-1的酸性KMnO4标准溶液装入酸式滴定管中,用氧化还原法测定柠檬酸亚铁晶体的质量分数,杂质不与酸性KMnO4标准溶液反应,经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
滴定终点时现象为:__________________________________柠檬酸亚铁的质量分数________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。常温下0.1mol·L-1 NaHC2O4溶液(pH约为4)中指定微粒的物质的量浓度关系错误的是
A. c(Na+)= c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)
)+c(H2C2O4)
B. c(HC2O4-)>c(H2C2O4)>c(C2O![]() )
)
C. c(Na+)+c(H+)=c(HC2O![]() )+ c(C2O
)+ c(C2O![]() )+c(OH-)
)+c(OH-)
D. c(H2C2O4)+c(H+)=c(C2O![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较正确的是( )
A. 第一电离能:I1(Na)>I1(Cl) B. 原子半径:r(C)>r(N)
C. 能级能量:E(2s)>E(3s) D. 电负性:O原子>F原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com