
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
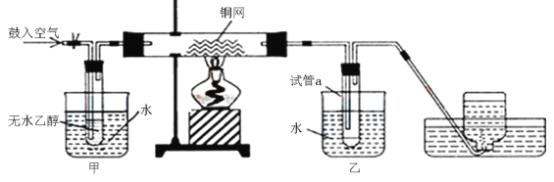
(1)实验过程中铜网处出现_______________现象,请写出相应的化学反应方程式:①___________,②___________;从中可认识到该实验过程中催化剂___________(填“参加”或“不参加”)化学反应。
(2)实验进行一段时间后,熄灭酒精灯,反应能继续进行,其原因是___________。
(3)甲和乙两个水浴作用不相同。甲的作用是___________;乙的作用___________ 。
(4)反应进行一段时间后,试管a中能收集到不同的物质,它们是___________。集气瓶中收集到的气体的主要成分是___________。(写名称)
【答案】先变黑再变红(红色黑色交替) 2Cu+O2![]() 2CuO C2H5OH+CuO
2CuO C2H5OH+CuO![]() CH3CHO+Cu+H2O 参加 该反应为放热反应 加热,使乙醇挥发 冷却,便于乙醛收集 乙醇、乙醛、水 氮气
CH3CHO+Cu+H2O 参加 该反应为放热反应 加热,使乙醇挥发 冷却,便于乙醛收集 乙醇、乙醛、水 氮气
【解析】
该实验将乙醇和空气都鼓入玻璃管中,玻璃管中的铜网在加热的条件下遇见氧气生成氧化铜,氧化铜再被乙醇还原生成铜。生成的乙醛和水及没反应的乙醇进入试管a中冷却下来,最后剩下的气体主要是氮气。
(1)在乙醇的催化氧化实验中,Cu作催化剂,反应过程中红色的Cu先被氧化为黑色的CuO,黑色的CuO又被乙醇还原为红色的Cu,所以现象是红色黑色交替,催化剂Cu参加了反应;有关的化学方程式为2Cu+O2![]() 2CuO;C2H5OH+CuO
2CuO;C2H5OH+CuO![]() CH3CHO+Cu+H2O;
CH3CHO+Cu+H2O;
(2)停止加热后反应依然能够进行,说明该反应放热,放出的热量能够让反应继续进行;
(3)根据分析,开始时需要将乙醇蒸汽吹入玻璃管,故需要加热,有利于乙醇的挥发;a管主要是将混合物液化,所以冷水浴,有利于乙醛的收集;
(4)根据分析,a管中主要收集到的物质是乙醇、乙醛、水;根据分析,空气中的氧气参加了反应,集气瓶中收集到的主要是氮气;


科目:高中化学 来源: 题型:
【题目】化合物M是制备一种抗菌药的中间体,实验室以芳香化合物A为原料制备M的一种合成路线如下:
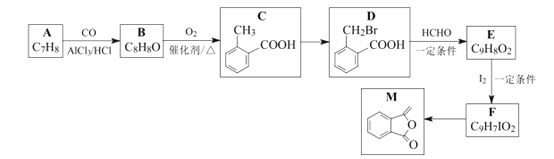
已知:R1CH2Br![]() R1CH=CHR2
R1CH=CHR2![]()
![]()
回答下列问题:
(1)B的化学名称为_________;E中官能团的名称为__________ 。
(2)C→D的反应类型为_______。
(3)写出D与氢氧化钠水溶液共热的化学方程式________________________。
(4)由F生成M所需的试剂和条件为_____________ 。
(5)X是D的同分异构体,同时符合下列条件的X可能的结构有______种(不含立体异构)。
①苯环上有两个取代基,含两个官能团; ②能发生银镜反应。
其中核磁共振氢谱显示4组峰的结构简式是___________(任写一种)。
(6)碳原子上连有4个不同的原子或原子团时,该碳称为手性碳。写出F的结构简式____________,用星号(*)标出F中的手性碳。
(7)参照上述合成路线和信息,以乙烯和乙醛为原料(无机试剂任选),设计制备![]() 的合成路线。______________________________。
的合成路线。______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓![]() 溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)( )
溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)( )
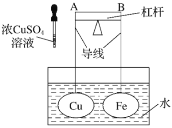
A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
D.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.11 g硫化钾和过氧化钾的混合物,含有的离子数目为0.4NA
B.28 g聚乙烯(![]() )含有的质子数目为16NA
)含有的质子数目为16NA
C.将标准状况下224 mLSO2溶于水制成100 mL溶液,H2SO3、HSO3-、SO32-三者数目之和为0.01NA
D.含63 gHNO3的浓硝酸与足量铜完全反应,转移电子数目为0.50NA
查看答案和解析>>
科目:高中化学 来源: 题型:
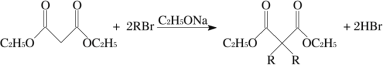
【题目】环丁基甲酸是有机合成中一种有用的中间体。某研究小组以丙烯醛为原料,设计了如下路线合成环丁基甲酸(部分反应条件、产物已省略)。
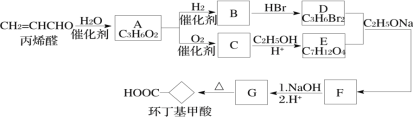
已知:
(1)
(2)![]()
请回答下列问题:
(1)由丙烯醛生成化合物A的反应类型为____________。
(2)化合物C的结构简式是________________________。
(3)下列说法中正确的是___________(填字母代号)。
A.丙烯醛可以发生银镜反应 B.化合物B和C能形成高聚物
C.化合物G的化学式为C6H8O4 D.1mol化合物B与足量金属钠反应能生成1mol氢气
(4)写出D+E→F的化学方程式:__________________________________________。
(5)符合下列条件的G的同分异构体有____________种,写出其中在1H-NMR谱上显示两组峰且面积比为3∶1的结构简式:______________________。
①能使Br2/CCl4溶液褪色;②1mol G与1mol Na2CO3反应可以生成1mol CO2
(6)以1,3-丁二烯和化合物E为原料可制备![]() ,请选用必要的试剂设计合成路线____________________。
,请选用必要的试剂设计合成路线____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光电池在光照条件下可产生电压,如下装置可以实现光能源的充分利用,双极性膜可将水解离为H+和OH-,并实现其定向通过。下列说法不正确的是
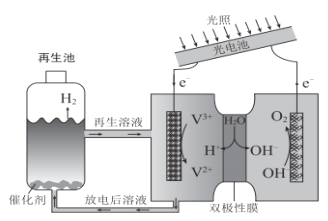
A.该装置将光能转化为化学能并分解水
B.双极性膜可控制其两侧溶液分别为酸性和碱性
C.如阳极区为KOH深液,在光照过程中阳极区溶液中的c(OH-)基本不变
D.再生池中的反应:2V2++2H+![]() 2V3++H2↑
2V3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种除草剂,可由下列路线合成(部分反应条件略去):

(1)B和A具有相同的实验式,分子结构中含一个六元环,核磁共振氢谱显示只有一个峰,则B的结构简式为__________,A→B的反应类型是__________。
(2)C中含氧官能团的名称是__________;ClCH2COOH的名称(系统命名)是__________。
(3)D→E所需的试剂和条件是__________。
(4)F→G的化学方程式是___________________。
(5)I是E的一种同分异构体,具有下列结构特征:①苯环上只有一个取代基;②是某种天然高分子化合物水解的产物。I的结构简式是__________。
(6)设计由乙醇制备![]() 的合成路线__________(无机试剂任选)。
的合成路线__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是( )
A.由Na和Cl形成离子键的过程:![]()
B.常温时,氨气溶于水显碱性:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-
NH4++OH-
C.FeCl3溶液中加入Fe粉,溶液变浅绿:Fe3++Fe=2Fe2+
D.电解饱和食盐水,产生黄绿色气体:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
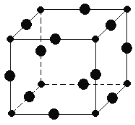
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中第________周期________族。
(2)C、N、O三种元素的第一电离能由大到小的顺序为________________。
(3)Cu+的电子排布式为________________________,其在酸性溶液中不稳定,可发生歧化反应生成Cu 2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O________________________________________。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是________,乙醛分子中H﹣C﹣O的键角________乙醇分子中的H﹣C﹣O的键角(填“大于”、“等于”或“小于”)。
(5)[Cu(H2O)4]2+中的两个H2O被Cl-取代有两种不同的结构,则[Cu(H2O)4]2+的结构为________形。
(6)Cu3N的晶胞结构如图,N3﹣的配位数为________,Cu+半径为a pm,N3﹣半径为bpm,Cu3N的密度________________g/cm3。(阿伏加德罗为常数用NA表示)(1pm=10﹣10 cm)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com