
【题目】白磷与氧气可发生如下反应:P4+5O2=P4O10,已知断裂下列化学键需要吸收的能量分别为:P-P a kJ/mol、P-O b kJ/mol、P=O c kJ/mol、O=O d kJ/mol。根据有关数据和右图所示的分子结构估算该反应的H,其中正确的是( )

A.(6a+5d-4c-12b)kJmol-1B.(4c+12b-6a-5d) kJmol-1
C.(4c+12b-4a-5d) kJmol-1D.(4a+Sd-4c-12b) kJmol-1
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】硫及其化合物用途广泛,研究硫及其化合物性质和用途意义重大。利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98kJ·mol-1。某温度下该反应的平衡常数K=
SO3(g) △H=-98kJ·mol-1。某温度下该反应的平衡常数K=![]() 。
。
(1)该温度下,向100 L的恒容密闭容器中,充入3.0molSO2(g)、16.0molO2(g)和3.0molSO3(g),则反应开始时v(正)__v(逆)(填“<”、“>”或“=”)。
(2)该温度下,向一体积为2L的恒容密闭容器中充入2.0molSO2和1.0molO2,反应一段时间后容器压强为反应前的80%,此时SO2的转化率为___。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__(填字母)。
A.保持温度和容器体积不变,充入1.0molO2
B.升高温度
C.保持温度和容器体积不变,充入1.0molSO3
D.增大容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁[Mgx(CO3)y(OH)z·wH2O]的主要流程如图:

(1)“溶解”时,加快溶解速率的措施有_______________(写一条)。
(2)“滤液”中的溶质主要有______________(写化学式)。
(3)已知高温煅烧碱式碳酸镁可得到MgO。请写出煅烧碱式碳酸镁发生的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化剂H2O2在反应时不产生污染物被称为“绿色氧化剂”,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。

(1)实验①和②的目的是___________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是__________(填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示。分析该图能够得出的实验结论是_______________。



Ⅱ.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验。
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量_________或________来比较。
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。请解释化学反应速率变化的原因:_______。请计算H2O2的初始物质的量浓度为__________(保留两位有效数字)。为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无需写出具体操作):a._______;b._______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知M(g)+N(g) ![]() P(g)+Q(g)反应的平衡常数和温度的关系如下:
P(g)+Q(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答:
(1)该反应的平衡常数表达式K=_____________ ,△H_____0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的M和0.80mol的N,若反应6s内M的平均反应速率v(M)=0.003 mol·L-1·s-1。,则6s时c(M)=______ mol·L-1, P的物质的量为_______mol;若反应经一段时间后,达到平衡时N的转化率为______。
(3)判断该反应是否达到平衡的依据为_______(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(M)不随时问改变 d.单位时间里生成P和Q的物质的量相等
(4)1200℃时反应P(g)+Q(g) ![]() M(g)+N(g)的平衡常数的值为______________。
M(g)+N(g)的平衡常数的值为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图,其中关于用途的描述,不正确的是( )
A.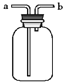 装置:收集二氧化碳,从a口进气b口排气
装置:收集二氧化碳,从a口进气b口排气
B. 装置:用于石油的分馏
装置:用于石油的分馏
C. 装置:用于分离Cl2与KI溶液反应生成的碘
装置:用于分离Cl2与KI溶液反应生成的碘
D.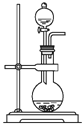 装置:可用来制取氨气
装置:可用来制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法不正确的是
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法不正确的是
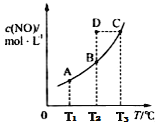
A. 该反应正反应的△H<0
B. 若状态A、B的逆反应速率分别为v逆(A)、v逆(B),则v逆(A)>v逆(B)
C. 在T2时,若反应体系处于状态D,则此时v正>v逆
D. 若状态B、C、D的压强分别为PB、PC、PD,则 PC>PD=PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:

(1)该温度时NH3·H2O的电离常数K=________。
(2)滴定过程中所用盐酸的pH=________。
(3)比较b、c、d三点时的溶液中,由水电离出的c(OH-)大小顺序为___________。(填字母)
(4)滴定时,由b点到c点的过程中,下列各选项中数值变大的是___(填字母,下同)。
A.c(H+)·c(OH-) B. c(H+)·c(NH3·H2O)/c(NH4+)
C. c(NH4+)·c(OH-)/c(NH3·H2O) D. c(H+)/c(OH-)
(5)根据以上滴定曲线判断下列说法正确的是________(溶液中N元素只存在NH4+和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(6)d点之后若继续加入盐酸至图像中的e点(不考虑NH4+水解的影响),则e点对应的横坐标为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2SO3(g)![]() 2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物 质 的量 /mol | 平衡时反应中的能量变化 | ||
SO3 | SO2 | O2 | ||
① | 2 | 0 | 0 | 吸收热量akJ |
② | 0 | 2 | 1 | 放出热 量 bkJ |
③ | 4 | 0 | 0 | 吸收热量ckJ |
下列叙述正确的是( )
A. 达平衡时O2的体积分数:①>③
B. 热量关系:a一定等于b
C. ①②③ 反应的平衡常数:③>①>②
D. ①中的密度不再改变时说明反应已达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com