
【题目】用0.1000mol/L的标准盐酸分别滴定20.00mL的0.1000mol/L氨水和20.00mL的0.1000mol/L氢氧化钠溶液的滴定曲线如图所示,横坐标为滴定百分数(滴定用量/总滴定用量),纵坐标为滴定过程中溶液pH,甲基红是一种酸碱指示剂,变色范围为4.4-6.2,下列有关滴定过程说法正确的是

A. 滴定氨水溶液当滴定分数为50%时,各离子浓度间存在关系:c(NH4+)+c(H+)=c(OH-)
B. 滴定分数为100%时,即为滴定过程中反应恰好完全的时刻
C. 从滴定曲线可以判断,使用甲基橙作为滴定过程中的指示剂准确性更佳
D. 滴定氨水溶液当滴定分数为150%时,所得溶液中离子浓度有大小关系c(Cl-)>c(H+)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为_________ 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_________ 。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2 |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为 (填序号)。

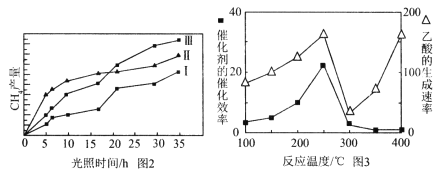
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下两种CH3COOH溶液a和b浓度分别为0.6mol/L和0.2mol/L,则a和b溶液中H+浓度之比为( )
A.小于3 B.大于3 C.等于3 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中SO2和NOx是形成酸雨的主要物质,危害环境。
(1)某研究小组为了探究参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有___________________________、_______________________;再喷射适量蒸馏水即可得硫酸型酸雨,其中NO的作用是______________________。
(2)减少SO2的污染并变废为宝是一项很重要的研究工作。我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式为_________________。
(3)有人提出:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4来脱除烟气中的SO2,原因是____________________(用离子方程式表示)
(4)为防止污染,将NO、NO2完全转化为最高价含氧酸盐,消耗1L2.4mol/LNaOH溶液和1molO2,则两种气体的物质的量分别为________________、___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1mol甲基中含有电子数为10NA
B. 常温下,1LpH=12的Na2CO3溶液中含有的OH-离子数为0.01 NA
C. 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA
D. 50mL12mol·L-1盐酸和足量MnO2共热,转移的电子数为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.C燃烧的热化学方程式为:C(s)+1/2O2(g)=CO(g) △H = 110.5kJ·mol-1
B.由H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1可知,若将含1molCH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量小于57.3kJ
C.碳酸氢钠水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应在__________min时达到平衡状态;
(2)该反应的化学方程式为_________________________________________________。
(3)反应开始至2 min,气体Z的反应速率为______________________________。
(4)若X、Y、Z均为气体,反应达到平衡时压强是开始时的____________倍;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com