
【题目】实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:
 它所对应的化学反应为:__________
它所对应的化学反应为:__________
(2)已知在400℃时,N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正_____v(N2)逆(填:>、<、=、不能确定);欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,
2NH3(g) ΔH<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正_____v(N2)逆(填:>、<、=、不能确定);欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,
可采取的正确措施是____________(填序号)
A. 缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:
A(g)+3B(g) ![]() 2C(g)+D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g)+D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
t/K | 300 | 400 | 500 | …… |
K/(mol·L-1)2 | 4×106 | 8×107 | K1 | …… |
请完成下列问题:
①判断该反应的ΔH _______0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是________ (填序号)。
A. 3v(B)(正)=2v(C)(逆) B.容器内压强保持不变
C.A和B的转化率相等 D.混合气体的密度保持不变
【答案】 C(s)+H2O (g) ![]() H2(g) + CO(g) = A > BD
H2(g) + CO(g) = A > BD
【解析】(1)平衡表达式为:K= C(H2)×C(CO)/ C(H2O),生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据元素守恒,故另一反应物为固体C,反应中它所对应反应的化学方程式为C(s)+H2O(g)![]() CO(g)+H2(g);
CO(g)+H2(g);
(2)一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则c(N2)=4mol/L,c(H2)=2mol/L,c(NH3)=4mol/L,则Q= c2(NH3)/ c(N2)c3(H2)== 42/4×23===0.5,说明反应达到平衡状态,则有v(NH3)正=v(NH3)逆。
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,
A.反应是气体体积减小的反应,缩小体积增大压强,反应速率增大,平衡逆向进行,故A正确;
B.反应是放热反应,升高温度,速率增大,平衡逆向进行,故B错误;
C.加催化剂改变反应速率,不改变平衡,故C错误;
D.使氨气液化移走,平衡正向进行,反应速率减小,故D错误;故答案为:=;A;
(3)A(g)+3B(g)![]() 2C(g)+D(s),反应是气体体积减小的反应,①平衡常数随温度变化,温度越高,平衡常数越大,平衡正向进行,正反应方向是吸热反应,△H>0,故答案为:>;
2C(g)+D(s),反应是气体体积减小的反应,①平衡常数随温度变化,温度越高,平衡常数越大,平衡正向进行,正反应方向是吸热反应,△H>0,故答案为:>;
②化学平衡标志是正逆反应速率相同,各组分含量保持不变;
A.反应速率之比等于化学方程式计量数之比,为正反应速率之比,2υ(B)正=3υ(C)逆,说明反应达到化学平衡状态,3υ(B)正=2υ(C)逆,比值错误,故A错误;
B.反应是气体体积减小的反应,容器内压强保持不变说明反应达到平衡状态,故B正确;
C.转化率和起始量变化量有关,A和B的转化率相等不能说明反应达到平衡状态,故C错误;
D.反应前后气体质量减小,容器体积不变,平衡移动,密度变化,所以混合气体的密度保持不变说明反应达到平衡状态,故D正确;故答案为:BD;


科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. C2H4和C4H8一定是同系物
B. 氯乙烯和聚乙烯均能发生加成反应
C. C3H2Cl6有4种同分异构体
D. 等质量的乙烯和乙醇完全燃烧消耗氧气的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含少量镁的铝粉制取纯净的Al(OH)3,下列操作步骤可行的组合是
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入足量二氧化碳 ⑤加过量烧碱溶液 ⑥加过量盐酸
A.②③④③B.①⑤④③C.①⑤③⑥③D.①⑤⑥③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
(2)③元素与⑩元素两者核电荷数之差是
(3)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下列空格. 实验原理(化学方程式):
实验现象:
结论:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用可再生能源代替石油和煤已经成为未来发展的趋势。甲醇作为重要的可再生能源具有广泛的开发和应用前景。工业上常利用反应CO(g)+2H2(g)![]() CH3OH(g)△H<0来合成甲醇.
CH3OH(g)△H<0来合成甲醇.
(1)经研究发现在230℃~270℃时合成最为有利.为探寻合成气最合适的起始组成比,分别在230℃、250℃和270℃时进行实验,实验结果如下图。230℃的实验结果所对应的曲线是______(填字母);从提高CO转化率的角度等综合分析,该温度下工业生产适宜采用的合成气组成n(H2):n(CO)的比值范围是______(填字母).

A.1~1.5B.2.5~3C.3.5~4.5
(2)制甲醇所需要的氢气,可通过下列反应制取:H2O(g)+CO(g)![]() H2(g)+CO2(g)△H<0,某温度下该反应的平衡常数K=1.回答下列问题:
H2(g)+CO2(g)△H<0,某温度下该反应的平衡常数K=1.回答下列问题:
①该温度下,若起始时c(CO)=2mol/L,c(H2O)=3mol/L,反应进行一段时间后,测得CO的浓度为1mol/L,则此时该反应v(正)______v(逆)(填“>”、“<”或“=”).
②若降低温度,该反应的K值将______(填“增大”、“减小”或“不变”).
(3)甲醇是一种化工原料,工业上合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g)△H=-90.8kJ/mol.
CH3OH(g)△H=-90.8kJ/mol.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCO、4molH2 |
CH3OH的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
①容器内压强P:P甲、P乙与P丙的关系是______(用“>”、“<”或“=”表示);
②变化的热量数值Q中,Q1与Q2的和是______(填具体数值).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】32 g某气体的分子数目与22 g 二氧化碳的分子数目相同,则该气体的摩尔质量为 ( )
A. 32 g B. 32 g·mol-1 C. 64 g·mol-1 D. 64 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是 __________(填写
化学式)。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶
液中,反应的离子方程式为__________。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:取稀释后溶液各20 mL分别加入3个洁净的小烧杯中;
步骤3:用硫酸将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 | 溶液的pH | 现象 |
a | 10 | 10 min后,红纸基本不褪色;4h后红纸褪色 |
b | 7 | 10 min后,红纸颜色变浅;4 h后红纸褪色 |
c | 4 | 10 min后,红纸颜色变得更浅;4h后红纸褪色 |
已知,溶液中Cl2、HC1O和ClO-物质的量分数(α) 随pH变化的关系如右图所示:
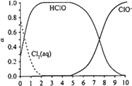
①由实验现象可获得以下结论:溶液的pH在4 ~10范围内,pH越大,红纸褪色________。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是________。
(4)由于氯气会与自来水中的有机物发生反应,生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是将SO2通入硫酸酸化的NaC1O3溶液中,反应的离子方程式为__________。
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3。则每生成0.5 mol ClO2,转移__________mole-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碘食盐中的碘是以碘酸钾(KIO3)形式存在的。已知在酸性溶液中IO3-和I-发生下列反应IO3-+5I-+6H+=3I2+3H2O。现有下列物质①稀硫酸;②pH试纸;③淀粉碘化钾溶液;④淀粉溶液。利用上述反应,可用来检验含碘食盐中含有IO3-的是( )
A、②④ B、①③ C、②③ D、①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com