
| A、① | B、③⑥ | C、②④⑥ | D、①③④ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
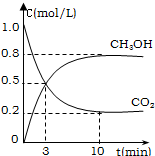 为减小CO2对环境的影响,在限制排放量的 同时,应加强对CO2创新利用的研究.利用CO2在适当条件下合成甲醇和水.在2L的密闭容器中,充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
为减小CO2对环境的影响,在限制排放量的 同时,应加强对CO2创新利用的研究.利用CO2在适当条件下合成甲醇和水.在2L的密闭容器中,充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)腐蚀电路板的反应为:Cu+2FeCl3=CuCl2+2FeCl2,
(1)腐蚀电路板的反应为:Cu+2FeCl3=CuCl2+2FeCl2,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、2:1 |
| C、1:2 | D、3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6种 | B、8种 | C、10种 | D、9种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com