
【题目】下列反应的离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
B.AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C.三氯化铁溶液中加入金属钠:3Na+Fe3+=3Na++Fe
D.NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】通过测定混合气中O2含量可计算已变质的Na2O2 (含Na2CO3) 纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是

A. 干燥管b中装入碱石灰
B. Q气球中产生的气体主要成份O2、CO2
C. 测定气体总体积必须关闭K1、K2,打开K3
D. 读完气体总体积后,关闭K3,缓缓打开K1;可观察到Q气球慢慢缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列流程有关判断正确的是
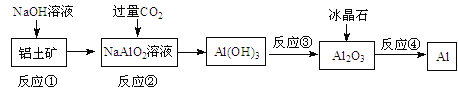
A.流程中涉及的反应均为非氧化还原反应
B.反应②产生的阴离子主要为CO32-
C.实验室中完成反应③应在蒸发皿中进行
D.反应④的条件是电解熔融
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
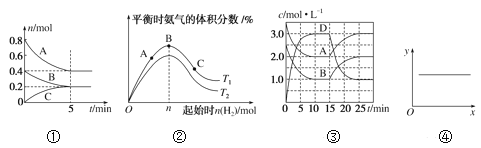
A. ①反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. ②N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,T1和T2表示温度,则:T1>T2
2NH3(g) ΔH<0,T1和T2表示温度,则:T1>T2
C. ③A(g)+B(g)![]() C(s)+2D(g) ΔH>0,反应至15min时,改变的条件是降低温度
C(s)+2D(g) ΔH>0,反应至15min时,改变的条件是降低温度
D. ④2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,当x表示温度时,y表示平衡常数K
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,当x表示温度时,y表示平衡常数K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g)=2NO2(g) △H= +67.7kJ·mol-1
N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H=-534.0kJ·mol-1
NO2(g)![]() 1/2N2O4(g) △H=-26.35kJ·mol-1
1/2N2O4(g) △H=-26.35kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:___。
Ⅱ.1100℃时,体积为2L的恒容容器中发生如下反应:Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是____。
A.容器中压强不变 B.混合气体密度不变
C.1molH-H键断裂同时形成2 mol H-O D.H2的体积分数不变
(2)若2min时反应达平衡,此时气体质量增加8g,则用H2表示该反应的反应速率为___。
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为_____。
(4)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数___(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm-3,钨的相对原子质量是183.9。假设金属钨原子为等径刚性球,试完成下列问题:
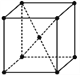
(1) 每一个晶胞中分摊到________个钨原子。
(2) 计算晶胞的边长a_____。
(3) 计算钨的原子半径r_____ (提示:只有体对角线上的各个球才是彼此接触的)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,总反应方程式为2CO2=2CO+O2,下列说法不正确的是
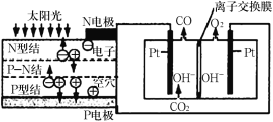
A.由图分析N电极为负极
B.OH-通过离子交换膜迁向右室
C.反应完毕,该装置中电解质溶液的碱性增强
D.阴极的电极反应式为CO2+H2O+2e-=CO+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解制碱的技术是用阳离子交换膜法,主要原料是饱和食盐水。图一为阳离子交换膜法电解原理示意图。请回答下列问题:
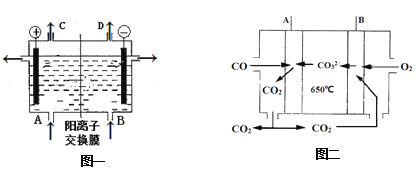
(1)反应的离子方程式是___。A、B、C、D所对应物质化学式分别为__________、____、______、_______,每通过0.1mol电子,就有0.1mol____(填离子符号)通过离子交换膜。
(2)若上述电解过程中用阴离子交换膜代替阳离子交换膜(已知:3Cl2 +6OH- = 5Cl-+ClO3-+3H2O),下列说法正确的组合是___________。
A.电解结束时,右侧溶液中含有ClO3—
B.电解槽内发生反应的总化学方程式为:NaCl + 3H2O ![]() NaClO3 + 3H2↑
NaClO3 + 3H2↑
C.用阴离子交换膜后,电解槽内两个电极发生的电极反应与原来一样
D.用阴离子交换膜后,阳离子的定向移动方向与原来相反
(3)如果用熔融碳酸盐CO燃料电池供电,图二为其工作原理,A、B极的电极反应分别是____、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制 500 mL 浓度为 0.2 mol·L-1 稀硫酸,需用量筒量取密度为 1.84 g·cm-3 溶质质量分数为98%的浓 H2SO4 __________mL,然后再与适量水混合稀释,待________ 后,再转移 到____中,定容,摇匀。
(2)在实验(1)中,其他操作均正确,但定容时俯视刻度线,会导致所配制的溶液中溶质的物质的量浓度_________ (填“大于”“小于”或“等于”)0.2 mol·L-1。
(3)在实验(1)中,转移溶液至容量瓶中时洒落少许,则所配制的溶液中溶质的物质的量浓度 (填 “大于”“小于”或“等于”)______________0.2 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com