
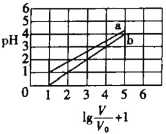
【题目】次磷酸(H3PO2一元弱酸)和氟硼酸(HBF4)均可用于植物杀菌。常温时,有1molL-1的H3PO2溶液和1molL-1的HBF4溶液,两者起始时的体积均为V0,分别向两溶液中加水,稀释后溶液的体积均为V,两溶液的pH变化曲线如图所示。下列说法错误的是
A.常温下,NaBF4溶液的pH=7
B.常温下,H3PO2的电离平衡常数约为1.1![]() 10-2
10-2
C.NaH2PO2 溶液中:c(Na+) =c( H2PO2- ) +c( HPO22-) +c(PO23-) +c( H3PO2)
D.常温下,在0≤pH≤4时,HBF4溶液满足![]()
【答案】C
【解析】
此题的横坐标是![]() ,V是加水稀释后酸溶液的体积,未稀释时,V=V0,横坐标值为1;稀释10倍时,V=10V0,横坐标值为2,以此类推。此题实际上考察的是稀释过程中,酸碱溶液pH的变化规律:越强的酸碱,稀释过程中pH的变化越明显;如果不考虑无限稀释的情况,对于强酸或强碱,每稀释十倍,pH变化1。根据此规律,再结合题干指出的次磷酸是弱酸这条信息,就可以明确图像中两条曲线的归属,并且可以得出氟硼酸是强酸这一信息。
,V是加水稀释后酸溶液的体积,未稀释时,V=V0,横坐标值为1;稀释10倍时,V=10V0,横坐标值为2,以此类推。此题实际上考察的是稀释过程中,酸碱溶液pH的变化规律:越强的酸碱,稀释过程中pH的变化越明显;如果不考虑无限稀释的情况,对于强酸或强碱,每稀释十倍,pH变化1。根据此规律,再结合题干指出的次磷酸是弱酸这条信息,就可以明确图像中两条曲线的归属,并且可以得出氟硼酸是强酸这一信息。
A.根据图像可知,b表示的酸每稀释十倍,pH值增加1,所以b为强酸的稀释曲线,又因为H3PO2为一元弱酸,所以b对应的酸只能是氟硼酸(HBF4),即氟硼酸为强酸;那么NaBF4即为强酸强碱盐,故溶液为中性,常温下pH=7,A项正确;
B.a曲线表示的是次磷酸的稀释曲线,由曲线上的点的坐标可知,1mol/L的次磷酸溶液的pH=1,即c(H+)=0.1mol/L;次磷酸电离方程式为:![]() ,所以1mol/L的次磷酸溶液中c(H3PO2)=0.9mol/L,c(
,所以1mol/L的次磷酸溶液中c(H3PO2)=0.9mol/L,c(![]() )=0.1mol/L,那么次磷酸的电离平衡常数即为:
)=0.1mol/L,那么次磷酸的电离平衡常数即为:![]() ,B项正确;
,B项正确;
C.次磷酸为一元弱酸,![]() 无法继续电离,溶液中并不含有
无法继续电离,溶液中并不含有![]() 和
和![]() 两类离子;此外,
两类离子;此外,![]() 还会发生水解产生次磷酸分子,所以上述等式错误,C项错误;
还会发生水解产生次磷酸分子,所以上述等式错误,C项错误;
D.令y=pH,x=![]() ,由图可知,在0≤pH≤4区间内,y=x-1,代入可得pH=
,由图可知,在0≤pH≤4区间内,y=x-1,代入可得pH=![]() ,D项正确;
,D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】PVAc是一种具有热塑性的树脂,可合成重要的高分子材料![]() ,合成路线如下:
,合成路线如下:
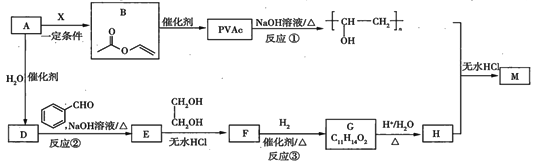
已知:
Ⅰ.![]() ;
;
Ⅱ.RCHO+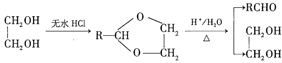
(1)标准状况下,![]() 气态烃
气态烃![]() 的质量是5.2g,则
的质量是5.2g,则![]() 的结构简式为___________。
的结构简式为___________。
(2)已知![]() 为加成反应,则
为加成反应,则![]() 的结构简式为_______;
的结构简式为_______;![]() 中所含官能团的名称是__________。
中所含官能团的名称是__________。
(3)反应①的化学方程式为__________________。
(4)反应③的化学方程式为__________________。
(5)在![]() 的转化过程中,乙二醇的作用是________________。
的转化过程中,乙二醇的作用是________________。
(6)已知![]() 的链节中除苯环外,还含有六元环状结构,则
的链节中除苯环外,还含有六元环状结构,则![]() 的结构简式为____________。
的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家从腐败草中提取出一种能使血液不凝固的双豆香素M,M的结构简式如图所示。下列说法正确的是( )
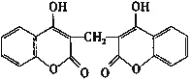
A.M能使溴水、酸性高锰酸钾溶液褪色,其褪色原理相同
B.M分子中所有原子可能处于同一平面
C.M分子中苯环上的一氯代物有4种
D.M分子有3种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示。下列说法正确的是( )

A.m=2
B.在Xm-中,硼原子轨道的杂化类型相同
C.1、2原子间和4、5原子间的化学键可能是配位键
D.Xm-中含离子键和配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1mol HClO 中含 H—Cl 键的数目为 0.1NA
B.1L 0.1molL-1NaAlO2 溶液中含 AlO2- 的数目为 0.1NA
C.含0.1mol AgBr的悬浊液中加入0.1mol KCl,充分反应后的水溶液中Br-的数目为0.1NA
D.9.2 g由甲苯(![]() )与甘油(丙三醇)组成的混合物中含氢原子的总数为0.8NA
)与甘油(丙三醇)组成的混合物中含氢原子的总数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Fe2(SO4)3溶液中加入KSCN溶液,发生反应:Fe3++SCN-[Fe(SCN)]2+;若加入K4[Fe(CN)6]溶液,两者发生反应会生成Fe4[Fe(CN)6]3沉淀。
(1)基态Fe原子的价电子排布式为_______,Fe原子失去电子变成阳离子时,首先失去的电子所处的轨道的形状为_______
(2)[Fe(SCN)]2+的四种元素中第一电离能最大的是_______ (填元素符号,下同),电负性最大的是_______。
(3)配合物Fe(CO)n可作催化剂,Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n =_______
(4)Fe4[Fe(CN)6]3中铁元素的化合价为_______。
(5)SO42-的立体构型为_______。
(6)铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg),铁镁合金的化学式为_______;若该晶胞为正方体,棱长为a cm,则镁原子与铁原子间的最短距离为_______cm,晶胞的密度为_______gcm-3。
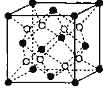
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经如图所示路线合成:
是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经如图所示路线合成:
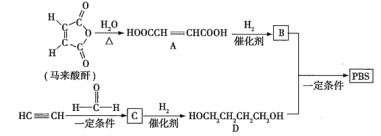
已知: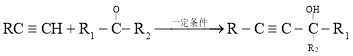 。
。
(1)![]() 的反应类型是___________;
的反应类型是___________;![]() 的结构简式是___________________。
的结构简式是___________________。
(2)![]() 中含有的官能团的名称是______________;
中含有的官能团的名称是______________;![]() 的名称(按系统命名法)是___________________。
的名称(按系统命名法)是___________________。
(3)半方酸是马来酸酐的同分异构体,分子中含有1个环(四元碳环)和1个羟基,但不含![]() 结构,半方酸的结构简式是_____________________。
结构,半方酸的结构简式是_____________________。
(4)由![]() 和
和![]() 合成
合成![]() 的化学方程式是____________________________。
的化学方程式是____________________________。
(5)下列关于![]() 的说法正确的有_____________(填序号)。
的说法正确的有_____________(填序号)。
a.能使酸性![]() 溶液、溴的
溶液、溴的![]() 溶液褪色
溶液褪色
b.能与![]() 溶液反应,但不与
溶液反应,但不与![]() 反应
反应
c.能与新制![]() 悬浊液反应
悬浊液反应
d.![]() 完全燃烧消耗
完全燃烧消耗![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是( )
A.用来制造电线电缆的聚乙烯树脂属于热塑性高分子材料
B.研发可降解高分子材料,可以减少“白色污染”
C.棉、麻、羊毛及合成纤维完全燃烧都只生成![]() 和
和![]()
D.硅橡胶![]() 可由
可由![]() 经水解、缩聚两步反应制得
经水解、缩聚两步反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,如图1装置(铁架台、酒精灯等略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5mL 1mol/L NaOH溶液和0.5mL溴乙烷振荡。
实验操作Ⅱ:将试管如图固定后,水浴加热。
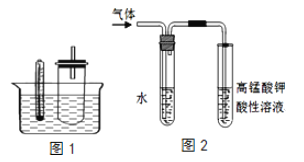
(1)据图1:用水浴加热而不直接用酒精灯加热的原因是________
(2)写出溴乙烷在NaOH水溶液中加热发生的化学反应方程式:________
(3)图2是为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,实验中需要检验的产物是:________ ,水的作用:________ ,实验现象是:________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com