
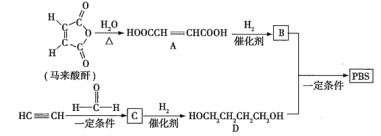
【题目】![]() 是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经如图所示路线合成:
是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经如图所示路线合成:
已知: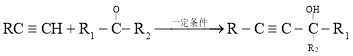 。
。
(1)![]() 的反应类型是___________;
的反应类型是___________;![]() 的结构简式是___________________。
的结构简式是___________________。
(2)![]() 中含有的官能团的名称是______________;
中含有的官能团的名称是______________;![]() 的名称(按系统命名法)是___________________。
的名称(按系统命名法)是___________________。
(3)半方酸是马来酸酐的同分异构体,分子中含有1个环(四元碳环)和1个羟基,但不含![]() 结构,半方酸的结构简式是_____________________。
结构,半方酸的结构简式是_____________________。
(4)由![]() 和
和![]() 合成
合成![]() 的化学方程式是____________________________。
的化学方程式是____________________________。
(5)下列关于![]() 的说法正确的有_____________(填序号)。
的说法正确的有_____________(填序号)。
a.能使酸性![]() 溶液、溴的
溶液、溴的![]() 溶液褪色
溶液褪色
b.能与![]() 溶液反应,但不与
溶液反应,但不与![]() 反应
反应
c.能与新制![]() 悬浊液反应
悬浊液反应
d.![]() 完全燃烧消耗
完全燃烧消耗![]()
【答案】加成反应(或还原反应) ![]() 碳碳三键、羟基 1,
碳碳三键、羟基 1,![]() 丁二醇
丁二醇 ![]() nHOOCCH2CH2COOH+nHOCH2CH2CH2OH
nHOOCCH2CH2COOH+nHOCH2CH2CH2OH![]()
 +(2n-1)H2O
+(2n-1)H2O ![]()
【解析】
(1)A的结构中含有碳碳双键,与H2发生加成反应生成物质B;
(2)结合题中已知信息,结合D的结构简式,可知乙炔与甲醛发生加成反应生成
![]() ;D是一个二元醇,D的名称是1,4—丁二醇;
;D是一个二元醇,D的名称是1,4—丁二醇;
(3)结合题中所要求的条件去找同分异构体;
(4)结合B与D的结构简式,B是一个二元羧酸,D是一个二元醇,它们发生缩聚反应;
(5)结合A的分子式,判断1molA完全燃烧消耗氧气的物质的量,结合A的结构简式判断A中的官能团,官能团为羧基和碳碳双键,因此A可以发生加成反应、可以与酸性高锰酸钾发生氧化反应、可以发生酸碱中和反应。
(1)A的结构中含有碳碳双键,与H2发生加成反应生成B(HOOCCH2CH2COOH);
(2)根据已知信息可知,甲醛与乙炔反应生成HOCH2C![]() CCH2OH,C中含有的官能团为碳碳三键和羟基;D的名称是1,4—丁二醇;
CCH2OH,C中含有的官能团为碳碳三键和羟基;D的名称是1,4—丁二醇;
(3)马来酸酐的分子式为C4H2O3,不饱和度为4,根据要求可写出半方酸的结枸简式为![]() ;
;
(4)HOOCCH2CH2COOH与HOCH2CH2CH2OH发生缩聚反应的化学方程式为nHOOCCH2CH2COOH+nHOCH2CH2CH2OH![]()
![]() +(2n-1)H2O;
+(2n-1)H2O;
(5)a.A分子中含有碳碳双键,可以被酸性高锰酸钾溶液氧化,使酸性高锰酸钾溶液褪色,能与Br2发生加成反应而使溴的CCl4溶液褪色,a说法正确;
b.A分子中含有碳碳双键,能与HBr发生加成反应,A分子中含有羧基,可以与Na2CO3溶液反应生成CO2,b说法不正确;
c.A分子内不含醛基,但含有羧基,能与新制![]() 悬浊液发生酸碱中和反应,c说法正确;
悬浊液发生酸碱中和反应,c说法正确;
d.A的分子式为C4H4O4,1molA完全燃烧消耗3molO2,d说法错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置 _________ ![]() 的中子数为______________________。
的中子数为______________________。
(2)热稳定性:NH3______________________PH3(填“>”或“<”)。
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是 ____________(填序号)。
a.不能与NaOH反应 b.含离子键、共价键 c.能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醇燃料电池的结构示意图。电池总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法正确的是( )

A.左电极为电池的负极,a处通入的物质是空气
B.右电极为电池的负极,b处通入的物质是甲醇
C.正极反应式为:O2+2H2O-4e-=4OH-
D.负极反应式为:CH3OH+H2O-6e-=CO2+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种粒子中,半径按由大到小顺序排列的是( )
①基态X的原子结构示意图为
②基态Y的价电子排布式为![]()
③基态Z2-的轨道表示式为![]()
④基态原子W有2个电子层,电子式为![]()
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
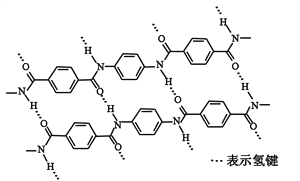
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分等电子体类型、代表物质及对应的空间构型如表所示:
等电子类型 | 代表物质 | 空间构型 |
四原子24电子等电子体 | SO3 | 平面三角形 |
四原子26电子等电子体 | SO32- | 三角锥形 |
五原子32电子等电子体 | CCl4 | 四面体形 |
六原子40电子等电子体 | PCl5 | 三角双锥形 |
七原子48电子等电子体 | SF6 | 八面体形 |
请回答下列问题。
(1)请写出下列离子的空间构型:
![]() ____________________,
____________________,![]() ____________________,
____________________,![]() ____________________。
____________________。
(2)由第2周期元素原子构成,与F2互为等电子体的离子是__________。
(3)![]() 的空间构型如图1所示,请再按照图1的表示方法在图2中表示出
的空间构型如图1所示,请再按照图1的表示方法在图2中表示出![]() 分子中O、S、F原子的空间位置。已知
分子中O、S、F原子的空间位置。已知![]() 分子中O、S间为共价双键,S、F间为共价单键。__________。
分子中O、S间为共价双键,S、F间为共价单键。__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 键和
键和![]() 键的理解不正确的是
键的理解不正确的是![]()
A. ![]() 键可以绕键轴旋转,
键可以绕键轴旋转,![]() 键不能绕键轴旋转
键不能绕键轴旋转
B. ![]() 分子中的
分子中的![]() 键是
键是![]()
![]() 键,HClO分子中的
键,HClO分子中的![]() 键都是
键都是![]()
![]() 键
键
C. ![]() 分子和
分子和![]() 中都是含有5个
中都是含有5个![]() 键
键
D. ![]() 键以“头碰头”方式重叠,
键以“头碰头”方式重叠,![]() 键以“肩并肩”方式重叠
键以“肩并肩”方式重叠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金晶体采取面心立方最密堆积。设金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。则下列说法错误的是( )
A.金晶体每个晶胞中含有4个金原子
B.金属键无方向性,金属原子尽可能采取紧密堆积
C.一个晶胞的体积是![]()
D.金晶体的密度是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制250mL一定物质的量浓度的盐酸,并用该盐酸滴定未知浓度的NaOH溶液,下列实验操作或说法错误的是
A.实验前,容量瓶和酸式滴定管都需要检查是否漏液
B.若NaOH溶液因久置而变质(含少量Na2CO3),用甲基橙作指示剂,对滴定结果无影响
C.若配制盐酸标准溶液定容时俯视刻度线,则所测定NaOH溶液的浓度偏小
D.当最后一滴盐酸标准液滴入锥形瓶中,溶液颜色由黄色变为橙色时,即达滴定终点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com