
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置 _________ ![]() 的中子数为______________________。
的中子数为______________________。
(2)热稳定性:NH3______________________PH3(填“>”或“<”)。
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是 ____________(填序号)。
a.不能与NaOH反应 b.含离子键、共价键 c.能与水反应
【答案】第四周期第ⅤA族 173 > b
【解析】
既然这五种元素都位于第![]() 族,则它们的化学性质相近,非金属性从上到下依次减弱,金属性依次增强,据此来分析本题即可。
族,则它们的化学性质相近,非金属性从上到下依次减弱,金属性依次增强,据此来分析本题即可。
(1)砷为第四周期第![]() 族元素,
族元素,![]() 的中子数为288-115=173;
的中子数为288-115=173;
(2)非金属性越强的元素,其气态氢化物的热稳定性越强,而氮元素的非金属性强于磷,故热稳定性有NH3>PH3;
(3)由NH3与HI反应生成NH4I,类推PH3与HI反应生成PH4I,再来分析选项:
a.NH4I可以和烧碱发生复分解反应,则PH4I应该也能和烧碱反应,a项错误;
b.NH4I含离子键、共价键,类推PH4I含离子键、共价键,b项正确;
c.NH4I不与水发生反应,则PH4I应该也不能和水反应,c项错误;
答案选b。


科目:高中化学 来源: 题型:
【题目】下图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是( )

A.工作时,a 极的电势低于 b 极的电势
B.工作一段时间之后,a 极区溶液的 pH 减小
C.a、b 极不能使用同种电极材料
D.b极的电极反应式为:CH3COO-+4H2O-8e-=2HCO3-+9H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关117号元素Ts(中文名“![]() ”,tiǎn)的说法不正确的是( )
”,tiǎn)的说法不正确的是( )
A.基态Ts原子的电子所在最高电子层的符号是Q
B.基态Ts原子有一个未成对电子
C.Ts的电负性在同周期主族元素中最大
D.基态Ts原子有7种能量不同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息回答问题:
A元素原子的核外电子数和电子层数相等
B元素原子的核外p电子数比s电子数少1
C元素的第一至第四电离能如下:![]()
![]()
![]()
![]()
D是前四周期中金属性最强的元素
E在周期表的第七列
(1)已知BA5为离子化合物,写出其电子式:__________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有___个伸展方向,原子轨道呈 _____ 形。
(3)某同学根据上述信息,推断C元素基态原子的轨道表示式为 ,该同学所画的轨道表示式违背了 __________________ 。
,该同学所画的轨道表示式违背了 __________________ 。
(4)E位于第 _________ 族、 _____ 区,该元素原子的核外电子排布式为 _______。
(5)检验D元素的方法是 _____ ,请用原子结构的知识解释产生此现象的原因:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a> c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ·mol-1)___________。
(2)倒入NaOH溶液的正确操作是__________(从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选项中选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经如图所示路线合成:
是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经如图所示路线合成:
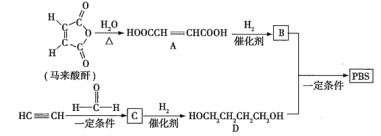
已知: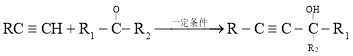 。
。
(1)![]() 的反应类型是___________;
的反应类型是___________;![]() 的结构简式是___________________。
的结构简式是___________________。
(2)![]() 中含有的官能团的名称是______________;
中含有的官能团的名称是______________;![]() 的名称(按系统命名法)是___________________。
的名称(按系统命名法)是___________________。
(3)半方酸是马来酸酐的同分异构体,分子中含有1个环(四元碳环)和1个羟基,但不含![]() 结构,半方酸的结构简式是_____________________。
结构,半方酸的结构简式是_____________________。
(4)由![]() 和
和![]() 合成
合成![]() 的化学方程式是____________________________。
的化学方程式是____________________________。
(5)下列关于![]() 的说法正确的有_____________(填序号)。
的说法正确的有_____________(填序号)。
a.能使酸性![]() 溶液、溴的
溶液、溴的![]() 溶液褪色
溶液褪色
b.能与![]() 溶液反应,但不与
溶液反应,但不与![]() 反应
反应
c.能与新制![]() 悬浊液反应
悬浊液反应
d.![]() 完全燃烧消耗
完全燃烧消耗![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com