
【题目】向Fe2(SO4)3溶液中加入KSCN溶液,发生反应:Fe3++SCN-[Fe(SCN)]2+;若加入K4[Fe(CN)6]溶液,两者发生反应会生成Fe4[Fe(CN)6]3沉淀。
(1)基态Fe原子的价电子排布式为_______,Fe原子失去电子变成阳离子时,首先失去的电子所处的轨道的形状为_______
(2)[Fe(SCN)]2+的四种元素中第一电离能最大的是_______ (填元素符号,下同),电负性最大的是_______。
(3)配合物Fe(CO)n可作催化剂,Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n =_______
(4)Fe4[Fe(CN)6]3中铁元素的化合价为_______。
(5)SO42-的立体构型为_______。
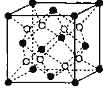
(6)铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg),铁镁合金的化学式为_______;若该晶胞为正方体,棱长为a cm,则镁原子与铁原子间的最短距离为_______cm,晶胞的密度为_______gcm-3。
【答案】3d64s2 球形 N N 5 +2、+3 正四面体 Mg2Fe ![]()
![]()
【解析】
(1)注意审题,书写基态Fe原子的价电子排布式即为3d64s2;原子变成阳离子时,首先失去最外层的电子,即4s能级的电子,这一能级轨道形状即为球形;
(2)Fe、S、C、N四种元素中第一电离能最大的是N元素,电负性最大的也是N元素;
(3)羰基铁配合物中中心原子为Fe,价电子数为8;配体为CO,配位原子为C,有一个孤对电子,所以有![]() ,所以n=5;
,所以n=5;
(4)K4[Fe(CN)6]中的Fe为+2价,所以Fe4[Fe(CN)6]3中铁元素的价态有+2和+3两种;
(5)通过VSEPR理论计算,硫酸根有4个价层电子对,没有孤电子对,所以其空间构型为正四面体;
(6)通过分析晶胞结构,Fe原子处在面心和顶点的位置,Mg原子处在内部,均摊法计算铁镁合金的晶胞中含有铁原子个数为=![]() =4个,镁原子个数为8个,所以化学式即为Mg2Fe;经过分析可知,该铁镁合金晶胞结构与CaF2相同,将晶胞分成相等的8个小正方体,Mg就处在每个小正方体的体心位置,所以Mg和Fe的最近距离即晶胞体对角线的
=4个,镁原子个数为8个,所以化学式即为Mg2Fe;经过分析可知,该铁镁合金晶胞结构与CaF2相同,将晶胞分成相等的8个小正方体,Mg就处在每个小正方体的体心位置,所以Mg和Fe的最近距离即晶胞体对角线的![]() ,即
,即![]() cm;晶胞的密度
cm;晶胞的密度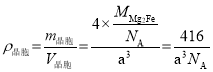 。
。


科目:高中化学 来源: 题型:
【题目】某届奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格。下图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )
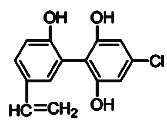
A.X分子中不可能所有原子都在同一平面上
B.X 遇到FeCl3溶液时显紫色,而且能使溴的四氯化碳溶液褪色
C.1 mol X 与足量的浓溴水反应,最多消耗5 mol Br2
D.1 mol X在一定条件下与足量的氢气反应,最多消耗1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH固体分别加入浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,lg![]() 随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是( )
随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是( )
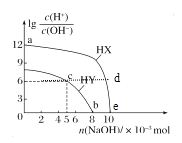
A.由a点到e点水的电离程度先增大后减小
B.d点溶液中存在:c(HX)+c(X-)=0.1mol/L
C.c点溶液中存在:c(Y-)+2c(OH-)=2c(H+)+c(HY)
D.b点溶液中存在:c(HY)+c(Na+)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃是一类重要的有机合成中间体,是许多有机合成的原料.根据卤代烃的相关性质,回答下列问题.
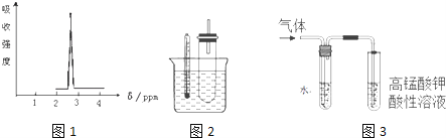
(1)化合物A的分子式是C3H6Br2,A的氢核磁共振氢谱图如图1所示,则A的结构简式为___________.
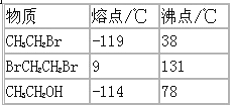
(2)某同学用如图2装置(铁架台、酒精灯等略)验证取代反应和消去反应的产物
实验操作Ⅰ:在试管中加入5mL1mol/LNaOH溶液和0.5mL溴乙烷振荡.
实验操作Ⅱ:将试管如图2固定后,水浴加热.
①据图1:用水浴加热而不直接用酒精灯加热的原因2是________.
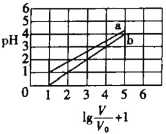
②图3是为证明溴乙烷在NaOH乙醇溶液中加热发生的是消去反应.
i实验中需要检验的产物是_______,水的作用是__________,实验现象是_________________.
ii若将“酸性高锰酸钾溶液”换成“Br2的CCl4溶液”,还需要装水的洗气装置吗________?(填“需要”或“不需要”),理由是________.
iii所检验的产物与Br2的CCl4溶液反应的化学方程式为___________.
(3)已知:
分离溴乙烷与1,2-二溴乙烷混合气体的方法是____________.
a.冰水浴冷却→过滤
b.水浴冷却→蒸馏
c.冰水浴冷却→加水萃取→分液
d.水浴冷却→加水萃取→分液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2一元弱酸)和氟硼酸(HBF4)均可用于植物杀菌。常温时,有1molL-1的H3PO2溶液和1molL-1的HBF4溶液,两者起始时的体积均为V0,分别向两溶液中加水,稀释后溶液的体积均为V,两溶液的pH变化曲线如图所示。下列说法错误的是
A.常温下,NaBF4溶液的pH=7
B.常温下,H3PO2的电离平衡常数约为1.1![]() 10-2
10-2
C.NaH2PO2 溶液中:c(Na+) =c( H2PO2- ) +c( HPO22-) +c(PO23-) +c( H3PO2)
D.常温下,在0≤pH≤4时,HBF4溶液满足![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物F可作为内燃机的润滑油,聚合物![]() (
(![]() )用于制备水凝胶,它们的合成路线如下:
)用于制备水凝胶,它们的合成路线如下:
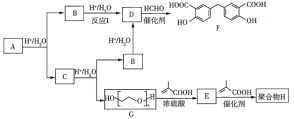
已知:![]() +(n-1)H2O
+(n-1)H2O
nCH2=CH2+nCH2=CHCH3![]()
![]()
(1)![]() 的分子式为
的分子式为![]() ,
,![]() 的化学名称是_________。红外光谱测定结果显示,
的化学名称是_________。红外光谱测定结果显示,![]() 中不含羟基。
中不含羟基。![]() 的反应类型是_____________。
的反应类型是_____________。
(2)![]() 的化学方程式是__________________。
的化学方程式是__________________。
(3)反应![]() 的另一种产物是
的另一种产物是![]() ,其相对分子质量是60,
,其相对分子质量是60,![]() 均能与
均能与![]() 溶液反应产生
溶液反应产生![]() 。
。
①![]() 的结构简式是_______________________。
的结构简式是_______________________。
②![]() 的化学方程式是________________________。
的化学方程式是________________________。
(4)下列说法正确的是_________________。
a.![]() 中均含有酯基
中均含有酯基
b.![]() 中所有碳原子一定在同一平面上
中所有碳原子一定在同一平面上
c.![]() 的同分异构体中能使
的同分异构体中能使![]() 溶液显色的共有1l种
溶液显色的共有1l种
(5)写出由乙烯和甲苯合成![]() 的路线:______________(其他试剂任选)。
的路线:______________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知卤代烃中卤素原子很容易发生取代反应,如:①R-X+NaCN![]() R-CN+NaX;②2R-X+2Na+X-R′
R-CN+NaX;②2R-X+2Na+X-R′![]() R-R′+2NaX。根据图中各物质的转化关系回答问题:
R-R′+2NaX。根据图中各物质的转化关系回答问题:
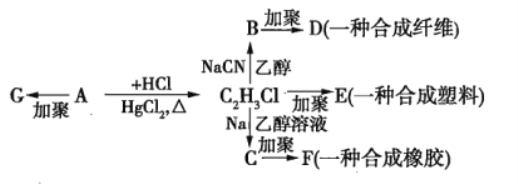
(1)![]() 的分子式为___________,
的分子式为___________,![]() 的结构简式为___________。
的结构简式为___________。
(2)写出![]() 的化学方程式:________。
的化学方程式:________。
(3)写出![]() 的化学方程式:____________。
的化学方程式:____________。
(4)写出![]() 的化学方程式:_____________。
的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象、结论均完全正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 在常温下测定Na2CO3和NaHCO3溶液的pH | Na2CO3溶液pH较大 | 水解能力:Na2CO3大于NaHCO3 |
B | 先向盛有1mL 0.1mol/L的AgNO3溶液的试管中滴加两滴0.1mol/L的NaCl溶液,再向其中滴加0.1mol/L的NaI溶液。 | 滴加NaCl溶液有白色沉淀生成,滴加NaI溶液后有黄色沉淀生成 | AgCl沉淀可转化成AgI沉淀 |
C | 电解饱和CuCl2溶液实验中,用润湿的淀粉—碘化钾试纸靠近阳极 | 润湿的淀粉—碘化钾试纸变蓝 | 阳极产生Cl2 |
D | 饱和FeCl3溶液中加入少量NaCl固体 | 溶液颜色变浅 | 加入NaCl固体后,FeCl3的水解平衡逆向移动 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com