
【题目】NaClO2是一种重要的杀菌消毒剂,消毒时本身被还原成氯离子,也常用来漂白织物等,其一种生产工艺如下:
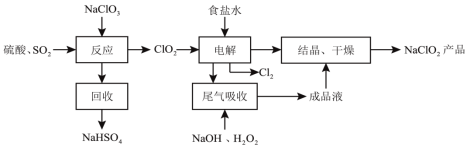
回答下列问题:
(1)NaClO2中Cl的化合价为__________。
(2)写出“反应”步骤中生成ClO2的离子方程式________,该过程体现了SO2的______________( 选填:a 氧化性、b还原性、c漂白性、d酸性氧化物的通性)
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去SO![]() 和Mg2+要加入的试剂分别为__________、__________。“电解”过程的氧化产物是Cl2,则还原产物是_______。
和Mg2+要加入的试剂分别为__________、__________。“电解”过程的氧化产物是Cl2,则还原产物是_______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应的化学方程式为__________,实验室进行结晶操作使用的仪器有铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳和__________。
(5)消毒能力可用单位质量消毒剂得电子多少来衡量。NaClO2与Cl2消毒能力比为___________。(不必化简)。
【答案】+3 2ClO![]() +SO2=2ClO2+SO
+SO2=2ClO2+SO![]() b BaCl2 NaOH NaClO2 2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2 蒸发皿 142:90.5
b BaCl2 NaOH NaClO2 2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2 蒸发皿 142:90.5
【解析】
根据流程,将硫酸、SO2中加入NaClO3,可制得ClO2气体和NaHSO4,可以回收并利用NaHSO4,将ClO2和食盐水一同电解,可制得Cl2和NaClO2,将制得的NaClO2进行结晶、干燥制得NaClO2成品,流程中加入硫酸和SO2的目的是为反应提供还原剂,使Cl转化为ClO2,进行下一步反应,电解过程中加入食盐水,目的是使ClO2转化为所要的NaClO2,食盐中含有较多可溶性杂质,使用时需要加入一定的化学试剂将杂质除去,得到纯净的食盐,据此分析。
(1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0,可得Cl的化合价为+3;
(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO3是氧化剂,还原产物为NaCl,根据得失电子守恒和原子守恒,此反应的离子方程式为2ClO![]() +SO2=2ClO2+SO
+SO2=2ClO2+SO![]() ;在反应中SO2的S元素化合价升高,体现了SO2的还原性;
;在反应中SO2的S元素化合价升高,体现了SO2的还原性;
(3)食盐溶液中混有SO![]() 和Mg2+,可利用过量NaOH溶液除去Mg2+,利用过量BaCl2溶液除去SO
和Mg2+,可利用过量NaOH溶液除去Mg2+,利用过量BaCl2溶液除去SO![]() ;向NaCl溶液中加入ClO2,进行电解,阳极发生反应2Cl--2e-=Cl2↑,反应产生Cl2,阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;
;向NaCl溶液中加入ClO2,进行电解,阳极发生反应2Cl--2e-=Cl2↑,反应产生Cl2,阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;
(4)根据图示可知:利用含有过氧化氢的NaOH溶液吸收ClO2气体,产物为NaClO2,则此吸收反应中,氧化剂为ClO2,还原产物为NaClO2,还原剂是H2O2,氧化产物是O2,化学反应方程式是:2NaOH+2ClO2+H2O2=2NaClO2+O2+2H2O;实验室进行结晶操作使用的仪器有铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳和蒸发皿;
(5)每克NaClO2的物质的量n(NaClO2)=![]() mol,其获得电子的物质的量是
mol,其获得电子的物质的量是![]() ×4=
×4=![]() mol;每克Cl2的物质的量n(Cl2)=
mol;每克Cl2的物质的量n(Cl2)=![]() mol,其获得电子的物质的量是
mol,其获得电子的物质的量是![]() ×2=
×2=![]() mol;则NaClO2与Cl2消毒能力比为
mol;则NaClO2与Cl2消毒能力比为![]() :
:![]() =142:90.5。
=142:90.5。


科目:高中化学 来源: 题型:
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体。CO2与化合物Ⅰ反应生成化合物Ⅱ,与化合物Ⅲ反应生成化合物Ⅳ,如反应①和②所示(其他试剂、产物及反应条件均省略)。
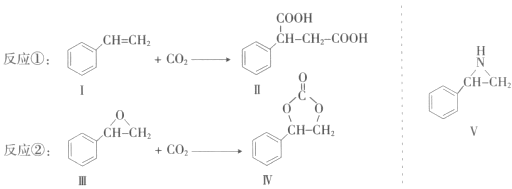
(1)化合物Ⅰ的分子式为______,1 mol该物质完全燃烧需消耗_______mol O2 。
(2)由![]() 通过消去反应制备Ⅰ的化学方程式为________(注明反应条件)。
通过消去反应制备Ⅰ的化学方程式为________(注明反应条件)。
(3)Ⅱ与过量C2H5OH在酸催化下发生酯化反应,生成的有机物的结构简式为________。
(4)在一定条件下,化合物V能与CO2发生类似反应②的反应,生成两种化合物(互为同分
异构体),请写出其中任意一种化合物的结构简式:________。
(5)与CO2类似,CO也能被固定和利用。在一定条件下,CO、![]() 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有________(双选,填字母)。
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有________(双选,填字母)。
A.都属于芳香烃衍生物 B.都能使溴的四氯化碳溶液褪色
C.都能与Na反应放出H2 D.1molⅥ或Ⅶ最多能与4molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘的废液(除H2O外,含有CCl4、I2、I 等)中回收碘,其实验过程如下,下列各项操作选用的装置不正确的是( )

选项 | A | B | C | D |
操作 | 操作X | 氧化 | 操作Y | 操作Z(加热及夹持装置略去) |
装置 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应。常温下,金属D单质投入水中能与水剧烈反应。常温下E单质是常见的气体。请按要求回答下列几个问题:
(1)B、D的元素名称分别为:________、________。
(2)E在周期表中的位置为:________。
(3)C离子的结构示意图为:________。
(4)B、C、D三种元素的原子半径从大到小的顺序为________(用元素符号表示)。
(5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:________(用对应的化学式表示)。
(6)写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下KClO3与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间,对图中各部位颜色描述正确的是

选项 | ① | ② | ③ | ④ |
A | 黄绿色 | 橙色 | 白色 | 蓝色 |
B | 无色 | 橙色 | 白色 | 紫色 |
C | 黄绿色 | 橙色 | 无色 | 蓝色 |
D | 黄绿色 | 无色 | 无色 | 紫色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,请回答下列问题
(1)基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(2)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 碳酸钙溶于稀醋酸:CaCO3+2H+=Ca2++H2O+CO2↑
B. 铜与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
C. 向NH4HCO3溶液中滴加过量Ba(OH)2溶液:HCO3-+OH-+Ba2+=H2O+BaCO3↓
D. 用银氨溶液检验乙醛中的醛基:CH3CHO+[Ag(NH3)2]++2OH- ![]() CH3COO-+NH4++NH3+ Ag↓+H2O
CH3COO-+NH4++NH3+ Ag↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制取乙烯的装置如下图,回答下列问题。

(1)仪器A的名称是__________ ;A中加入沸石的目的是 __________;在烧杯中配制A中溶液的方法是__________ ;在反应中浓硫酸的作用是__________;A中发生反应的化学方程式是 __________ 。
(2)A中产生的气体除乙烯外,还可能混有少量 __________(填化学式)
(3)用乙烯制聚乙烯的化学方程式为 __________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com