
【题目】 盐酸普罗帕酮是一种高效速效抗心律失常药。合成此药的原料D的流程如下:

已知:
请回答以下问题:
(I)A的化学名称为____,试剂a的结构简式为____。
(2)C的官能团名称为____________。
(3)反应⑤的反应类型为____;反应①和⑤的目的为_______。
(4)满足下列条件的B的同分异构体还有 ___种(不包含B)。其中某同分异构体x能发生水解反应,核磁共振氢谱有4组峰且峰面积比为3:2:2:1,请写出x与NaOH溶液加热反应的化学方程式____。
①能发生银镜反应 ②苯环上有2个取代基
(5)关于物质D的说法,不正确的是____(填标号)。
a.属于芳香族化合物
b.易溶于水
c.有三种官能团
d.可发生取代、加成、氧化反应
【答案】邻羟基苯甲醛(2-羟基苯甲醛) ![]() 羟基,羰基 取代反应 保护羟基不被氧化 11
羟基,羰基 取代反应 保护羟基不被氧化 11 ![]() bc
bc
【解析】
C为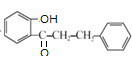 ;
;
(I) 按命名规则给A命名,结合题给信息与反应②中的反应物和产物结构,找出试剂a,可确定结构简式;
(2) 由反应⑤⑥找到C的结构简式,并且找出其的官能团写名称即可;
(3) 找到C的结构简式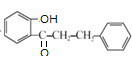 是关键,从流程开始的物质A
是关键,从流程开始的物质A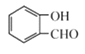 到C
到C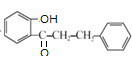 ,可发现只有醛基被消除,由此可发现⑤的反应类型及反应①和⑤的目的;
,可发现只有醛基被消除,由此可发现⑤的反应类型及反应①和⑤的目的;
(4)从B的结构![]() 出发,满足条件的B的同分异构体(不包含B)中,先找出条件对应的基团及位置,最后再确定总数目,同分异构体x与NaOH溶液加热下反应,则X含酯基,X核磁共振氢谱有4组峰且峰面积比为3:2:2:1,确定X结构即可求解;
出发,满足条件的B的同分异构体(不包含B)中,先找出条件对应的基团及位置,最后再确定总数目,同分异构体x与NaOH溶液加热下反应,则X含酯基,X核磁共振氢谱有4组峰且峰面积比为3:2:2:1,确定X结构即可求解;
(5) 关于物质D的说法不正确的有哪些?从结构中含有苯环、醚键、羰基、醇羟基等基团的相关概念、性质判断;
(I) A为 ,则其名称为:邻羟基苯甲醛(2-羟基苯甲醛);
,则其名称为:邻羟基苯甲醛(2-羟基苯甲醛);
答案为:邻羟基苯甲醛(2-羟基苯甲醛);
题给信息 ,反应②为
,反应②为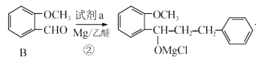 ,则试剂a为
,则试剂a为![]() ;
;
答案为:![]() ;
;
(2) 由反应⑤⑥找到C的结构简式: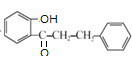 ,官能团为羟基和羰基;
,官能团为羟基和羰基;
答案为:羟基;羰基;
(3) C的结构简式是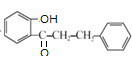 ,
,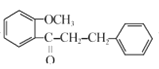 与HI在加热下发生反应⑤得到
与HI在加热下发生反应⑤得到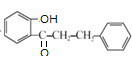 ,可见是-OCH3中的-CH3被H取代了;从流程开始的物质A
,可见是-OCH3中的-CH3被H取代了;从流程开始的物质A 到C
到C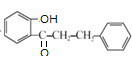 ,为什么不采用以下途径:
,为什么不采用以下途径: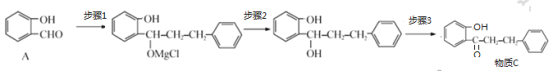 主要是步骤3中醇羟基被氧化成羰基时,酚羟基也会被氧化,因此反应①和⑤的目的为保护羟基不被氧化;
主要是步骤3中醇羟基被氧化成羰基时,酚羟基也会被氧化,因此反应①和⑤的目的为保护羟基不被氧化;
答案为:取代反应;保护羟基不被氧化;
(4)B的同分异构体(不包含B)要满足条件 ①能发生银镜反应②苯环上有2个取代基,其中有一个醛基(含甲酸酯基),且取代基可以是邻、间、对3种位置,则2个取代基可以有四种组合:首先是![]() 和
和![]() ,它们分别处于间、对,共2种(处于邻位就是B要排除),剩下3种组合分别是
,它们分别处于间、对,共2种(处于邻位就是B要排除),剩下3种组合分别是![]() 、
、![]() 、
、![]() ,它们都可以是邻、间、对3种位置,就9种,合起来共11种;
,它们都可以是邻、间、对3种位置,就9种,合起来共11种;
答案为:11;
某同分异构体x能与NaOH溶液加热下反应,则X含甲酸酯基,则X中苯环上的侧链为![]() ,X核磁共振氢谱有4组峰且峰面积比为3:2:2:1,则取代基处于对位,因此X为
,X核磁共振氢谱有4组峰且峰面积比为3:2:2:1,则取代基处于对位,因此X为![]() ,则反应方程式为
,则反应方程式为![]() ;
;
答案为:![]()
(5) D为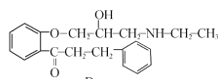 ,关于物质D的说法:
,关于物质D的说法:
a.因为含有苯环,属于芳香族化合物,a说法正确,不符合;
b.亲水基团少,憎水基团大,不易溶于水,b说法不正确,符合;
c.含氧官能团有3种,还有1种含氮官能团,c说法不正确,符合;
d.醇羟基可发生取代、氧化,羰基、苯环上可催化加氢反应,d说法正确,不符合;
答案为:bc。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)乙炔在Pd表面选择加氢的反应机理如图,其中吸附在Pd表面上的物种用*标注。

上述反应为_____(填“放热”或“吸热”)反应,历程中最小能垒(活化能)为_____kJ/mol,该步骤的化学方程式为_____。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的氮氧化物脱除技术。原理为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol,在2 L密闭容器中,使用不同的催化剂A、B、C,产生N2的物质的量随时间变化如图所示。下列说法正确的_____。
5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol,在2 L密闭容器中,使用不同的催化剂A、B、C,产生N2的物质的量随时间变化如图所示。下列说法正确的_____。

A.用催化剂A前50s平均反应速率v(N2)=2.5×10﹣2 mol/(Ls)
B.体系各物质状态不变时,反应在任何温度下均可自发进行
C.分离出体系中的H2O(g)有利于氮氧化物的脱除
D.用催化剂C达到平衡时,N2产率最小
(3)废气的变废为宝越来越成为人们共同关注的焦点,某化学课外小组查阅资料得知:
2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)![]() N2O2(g) (快) v1正=k1正c2(NO),v1逆═k1逆c(N2O2) △H1<0
N2O2(g) (快) v1正=k1正c2(NO),v1逆═k1逆c(N2O2) △H1<0
Ⅱ.N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2) △H2<0
2NO2(g)(慢) v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2) △H2<0
请回答下列问题:
①一定温度下,2NO(g)+O2(g)![]() 2NO2(g)平衡常数K=_____(用k1正、k1逆、k2正、k2逆表示)。
2NO2(g)平衡常数K=_____(用k1正、k1逆、k2正、k2逆表示)。
②研究发现NO转化为NO2的反应速率随温度的升高而减慢,原因是_____。
③已知:N2O4(g)![]() 2NO2(g),N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2)。一定温度下,相应的速率与压强关系如图所示,图中能表示该反应达到平衡状态的两个点是_____,可以表示该反应正向进行的两个点是_____。
2NO2(g),N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2)。一定温度下,相应的速率与压强关系如图所示,图中能表示该反应达到平衡状态的两个点是_____,可以表示该反应正向进行的两个点是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有重要作用。请按要求回答下列相关问题:
(1)食品添加剂铵明矾NH4Al(SO4)2·12H2O高温可分解,下列关于其分解产物的预测不合理的是_______。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(2)肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料。
①肼的电子式___________。
②64.0克肼在氧气中完全燃烧生成氮气和液态水放出热量1248kJ(在101kPa,25℃),则表示肼燃烧热的热化学方程式为________________________________________。
(3)工业合成氨的反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
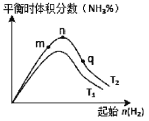
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是__________点。
②图像中T2______T1(填“高于”、“低于”、“等于”或“无法确定”),理由是____________。
③在绝热容器中进行该反应时,压缩容器体积,平衡常数__________(填“变大”“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g)△H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
化学键 | C—H | H—H | C=O |
|
键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
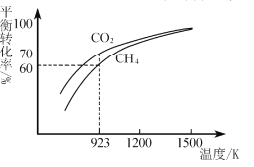
①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
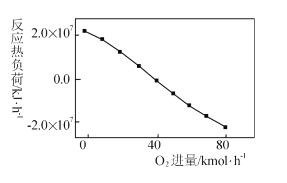
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是 ( )
A. 浓硫酸稀释时溶液温度升高,说明浓硫酸稀释时只有水合过程
B. 蔗糖是非电解质,放入水中溶液温度没有明显变化,说明蔗糖溶于水既没有扩散过程又没有水合过程
C. 家用石碱(![]() )久置后,由块状变成粉末状,这一变化是风化的结果
)久置后,由块状变成粉末状,这一变化是风化的结果
D. 从冰箱中取出物品,表面很快出现水珠,这种现象叫潮解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.澄清透明的溶液中:Na+、Cu2+、NO3-、Cl-
B.中性溶液中:Fe3+、NH4+、Br-、HCO3-
C.c(OH-)<![]() 的溶液中:Na+、Ca2+、ClO-、F-
的溶液中:Na+、Ca2+、ClO-、F-
D.1 mol/L的KNO3溶液中:H+、Fe2+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
A. 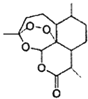 青蒿素的分子式是
青蒿素的分子式是![]()
B. 青蒿素所有碳原子均在同一平面上
C. 青蒿素在碱性条件下不能稳定存在
D. 青蒿素可以发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
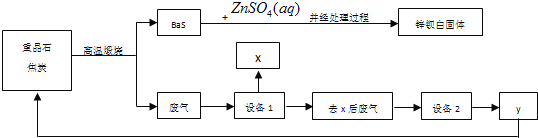
请根据上述流程回答下列问题:
(1)重晶石的化学式为_______,锌钡白可用于调制_____色和浅色油漆。
(2)处理过程![]() 的步骤为:①_________;②洗涤;③______________。
的步骤为:①_________;②洗涤;③______________。
(3)设备1是冷却分离塔,若设备1前面的导气管过长、过窄,可能使导气管堵塞,其原因是__________________________________。
(4)检验锌钡白中含有S2-的方法是________________________________________。
(5)设备2中所用的洗涤剂是NaOH溶液,则y的化学式为________。写出设备2中发生反应的离子方程式:___________________________________、_________________________________。
(6)可用_______法分离溶液中的钠盐,进行分离前,需要查得的是______________________。
(7)制备过程中得到的硫磺,除了可用来制硫酸外,其它的用途为___________(至少写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁、铝混合物进行如下实验:
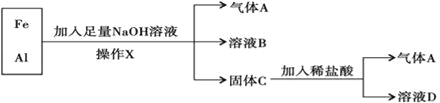
操作X的名称是_____,若铝和铁的物质的量相等,前后两次生成气体A的物质的量之比为______,溶液B中阴离子除OH﹣外还有______,溶液D中存在的金属离子主要为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com