
【题目】关于铝及其化合物的离子方程式正确的是
A. 向NaOH溶液中加入铝粉:Al + OH—+ H2O → AlO2— + H2↑
B. 向AlCl3溶液中通入过量氨气:Al3+ + 3OH— → Al(OH)3 ↓
C. 向Al(OH)3 中加入NaOH溶液 :Al(OH)3 + OH— → AlO2— + 2H2O
D. 明矾净水的原理:Al3+ + 3H2O ![]() Al(OH)3↓ + 3H+
Al(OH)3↓ + 3H+
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】硫元素的几种化合物存在下列转化关系:
![]()
下列判断不正确的是
A. 反应①中浓硫酸作氧化剂 B. 反应②表明SO2有酸性氧化物的性质
C. 反应③的原子利用率是100% D. 反应④稀H2SO4作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.浓硫酸在空气中敞口放置一段时间,浓度变小
B.铁片投入冷的浓硝酸中,铁片不溶解
C.铜片投入浓硝酸中,产生红棕色气体
D.石蕊溶液滴入稀硫酸中,溶液变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过所学知识,回答下面问题
(1)写出铁与水蒸气在高温下反应方程式_______________________________________。
(2)加热碳酸氢钠的化学方程式为______________________________________
(3)在呼吸面具中,Na2O2起反应的化学方程式为__________________。当有7.8克Na2O2反应时,放出氧气的质量为__________。
(4)将铜片投入到FeCl3溶液中恰好完全反应,发生的反应离子方程式为___________。
(5)向FeSO4溶液中滴加NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。写出此变化过程的化学方程式: __________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、氯、氮是三种常见的非金属元素。
完成下列填空:
(1)我们祖先的四大发明之一黑火药的爆炸反应为:S+2KNO3+3C A+N2↑+3CO2↑(已配平)。氮原子核外电子排布式为______________,生成物固体 A属于_____晶体。
(2)工业合成氨可以实现大规模固氮,氨可用于生产氯化铵、硫酸铵等化学肥料,等物质的量浓度的两溶液相同温度下pH大小为:氯化铵___________硫酸铵(选填>、=或<)。
(3)工业上在催化剂条件下,用NH3作为还原剂将烟气中的NO2还原成无害的氮气和水,反应方程式可表示为:8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g),用单线桥标出该反应电子转移的方向和数目______,若该反应氧化产物比还原产物多0.1mol,被吸收的NO2在标准状况下的体积为_________。
7N2(g)+12H2O(g),用单线桥标出该反应电子转移的方向和数目______,若该反应氧化产物比还原产物多0.1mol,被吸收的NO2在标准状况下的体积为_________。
(4)氯水成分的多样性决定了其性质的复杂性,氯气可用作自来水生产过程中的消毒剂,写出其中主要的化学反应方程式______________________________,在硝酸银溶液中滴加氯水,可以看到有白色沉淀产生,起作用的微粒是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CO(g)+2H2(g)CH3OH(g).反应的平衡常数如表:下列说法正确的是( )
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×102 | 2.4×104 | 1×105 |
A. 该反应的△H>0
B. 加压缩体积或增大CO浓度都能提高CO的转化率
C. 工业上采用高温高压的条件,目的都是提高原料气的转化率
D. t℃时,向1L密闭容器中投入0.1molCO和0.2molH2,平衡时CO转化率为50%,则该反应温度在0-100℃之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)已知2A2(g)+B2(g)![]() 2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
(1)比较a___b(填“>、=、<”)
(2)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(3)下图表示此反应的反应速率v和时间t的关系图。根据下图判断,在t1和t4时刻改变的外界条件分别是_______________和 _____________ 。
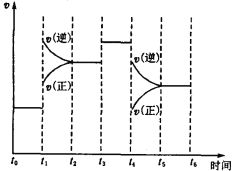
(二)在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
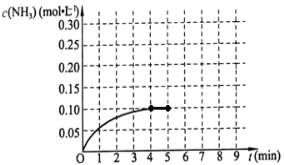
(1)根据上图,该反应达到平衡时H2的转化率等于__________。
(2)第5分钟末,保持其它条件不变,若改变反应温度,达新平衡后NH3的物质的量浓度不可能为_________。(填序号)。
a 0.20mol·L-1 b 0.12 mol·L-1 c 0.10 mol·L-1 d 0.08 mol·L-1
(3)若在第5分钟末将容器的体积缩小一半后,在第8分钟达到新的平衡(此时NH3的浓度约为0.25 mol·L-1 ),请在上图中画出第5分钟到9分钟NH3浓度的变化曲线。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)请写出元素d的基态原子电子排布式______________________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是_________________。(填“极性键”、“非极性键”)其中b原子的杂化方式是________。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为Mr,则一个晶胞中a原子的数目为________,该晶体的密度为 _______________________________(用字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com